Fascynuje Cię potencjał optogenetyki i najnowsze osiągnięcia w neuromodulacji? Chcesz dowiedzieć się więcej lub potrzebujesz wsparcia w badaniach naukowych? Skontaktuj się z nami! Jeśli Twoja praca doktorska dotyczy tych innowacyjnych dziedzin, oferujemy specjalistyczne konsultacje i pomoc.
Dlaczego ten temat jest ważny?
Wyobraź sobie możliwość precyzyjnego włączania i wyłączania aktywności konkretnych komórek nerwowych za pomocą światła – niczym przełącznikiem. Brzmi jak technologia z przyszłości? A jednak, optogenetyka, technika bioinżynieryjna opracowana na początku XXI wieku, właśnie to umożliwia. To rewolucyjne podejście otwiera drzwi do zrozumienia skomplikowanych mechanizmów działania mózgu, a także do opracowywania nowatorskich terapii chorób neurologicznych i psychiatrycznych, od ślepoty po depresję. Zrozumienie, jak działa i jakie ma perspektywy, to klucz do docenienia jej potencjału w zmienianiu naszego podejścia do medycyny i neuronauki.
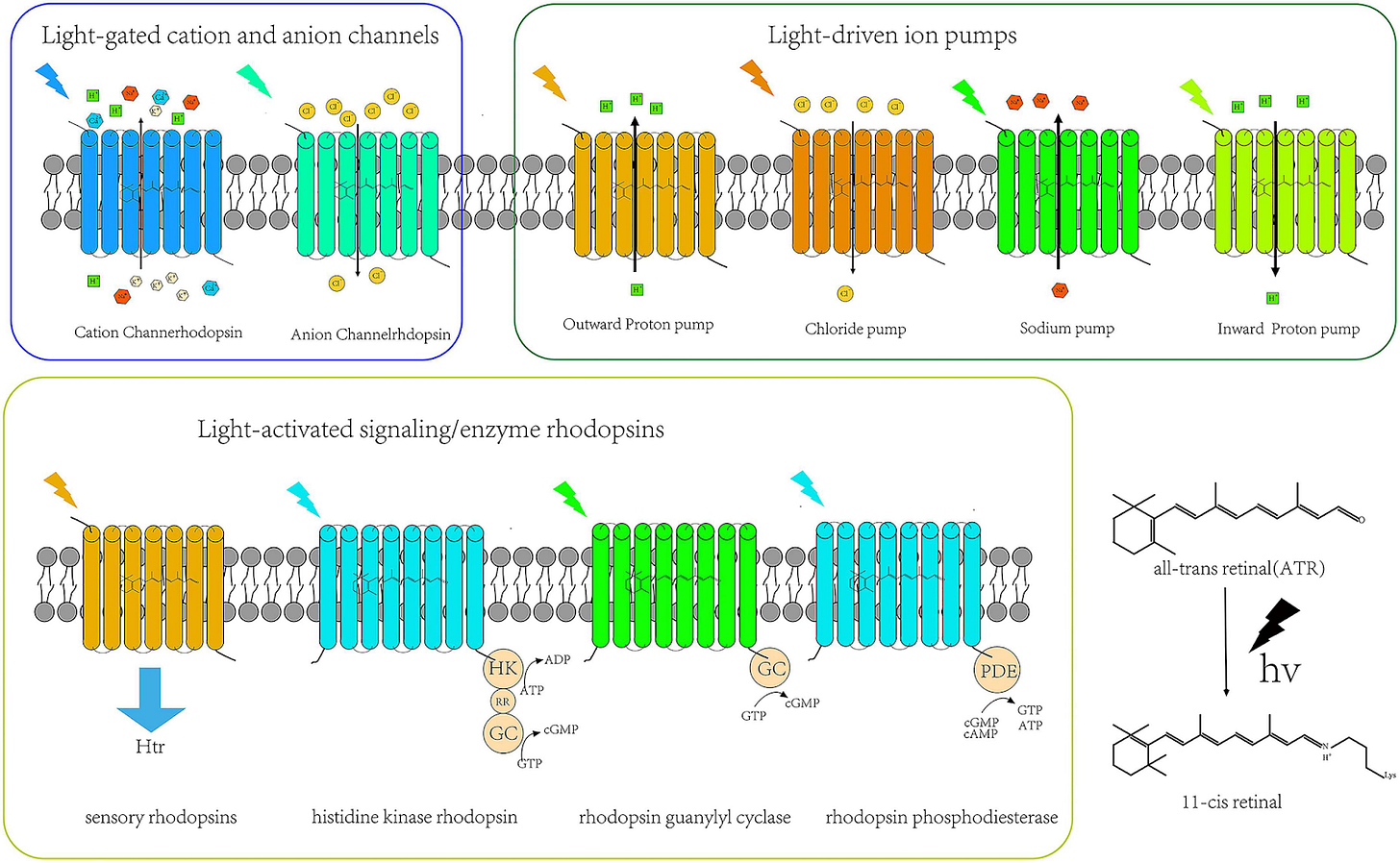
Optogenetyka to fascynująca dziedzina bioinżynierii, która pozwala naukowcom na bezpośrednią kontrolę aktywności neuronów za pomocą światła. Jak to możliwe? Kluczową rolę odgrywają tu kanałorodopsyny – specjalne białka (kanały jonowe i pompy) pochodzące głównie z bakterii i alg, które otwierają się pod wpływem światła.
Jak to działa w uproszczeniu?
Podobnie jak rodopsyna w ludzkim oku przekształca światło w sygnały chemiczne umożliwiające widzenie, tak kanałorodopsyny używane w optogenetyce zmieniają swoją strukturę pod wpływem światła. Ta zmiana pozwala jonom (naładowanym cząsteczkom) wnikać do neuronu, co prowadzi do jego pobudzenia lub zahamowania.
Dlaczego kanałorodopsyny, a nie „nasza” rodopsyna?
Choć ludzka rodopsyna (obecna naturalnie w komórkach siatkówki) również reaguje na światło, jej mechanizm działania jest bardziej złożony i wolniejszy. Rodopsyna aktywuje kaskadę sygnałową białka G, która dopiero pośrednio wpływa na kanały jonowe. To świetne rozwiązanie dla skomplikowanego procesu widzenia u ssaków, ale zbyt powolne i skomplikowane do precyzyjnej, natychmiastowej kontroli aktywności neuronów.
Kanałorodopsyny są inne – to same w sobie są kanałami jonowymi bramkowanymi światłem. Omijają pośredników: pod wpływem światła natychmiast się otwierają, pozwalając na przepływ jonów i bezpośrednią zmianę potencjału błonowego neuronu, zmuszając go do „wystrzelenia” (aktywacji) lub wyciszenia.
Jeśli naukowcy zmuszą neuron do produkcji kanałorodopsyn (poprzez inżynierię genetyczną), zyskują precyzyjny „przycisk”, którym mogą włączać i wyłączać neuron w skali femtosekund – o ile światło może do niego dotrzeć.
Zastosowania: Od Badań Podstawowych po Terapie
Możliwość tak precyzyjnej kontroli neuronów ma ogromne znaczenie:
-
Badania Podstawowe w Neuronauce:
-
Badania utraty i zysku funkcji: Można „wyłączać” określone regiony mózgu, aby zbadać ich konieczność dla danej funkcji, bez potrzeby trwałego uszkadzania tkanki (jak w przypadku lezji).
-
Badania wystarczalności: Można na żądanie pobudzać neurony i obserwować efekty, bez konieczności stosowania stymulacji elektrycznej.
-
Mniejsza inwazyjność: Minimalizuje uszkodzenia organizmów modelowych.
-
Selektywność: Można wybrać, które typy komórek nerwowych będą produkować kanałorodopsyny, co pozwala dokładniej badać rolę różnych grup neuronów.
-
-
Potencjał w Opiece Zdrowotnej:
-
Leczenie Ślepoty: Jednym z najbardziej obiecujących zastosowań jest leczenie ślepoty spowodowanej neurodegeneracją siatkówki. Grupa pod kierownictwem José-Alaina Sahela zdołała częściowo przywrócić wzrok pacjentowi z barwnikowym zwyrodnieniem siatkówki, wstrzykując białka kanałorodopsyny do jego chorego oka i stosując specjalne gogle stymulujące światłem. Pacjent, który wcześniej nie był w stanie dostrzegać obiektów, podczas stymulacji mógł je lokalizować i chwytać!
-
Leczenie Depresji: Optogenetyka może pomóc w leczeniu depresji i jej objawów. Na przykład, grupa Allyson Friedman odkryła, że poprzez hiperstymulację neuronów dopaminergicznych w śródmózgowiu można odwrócić fenotyp depresji u modeli zwierzęcych. Badania te pomagają również neurofarmakologom zrozumieć, które szlaki nagrody są zaburzone w depresji, co może prowadzić do opracowania lepszych leków przeciwdepresyjnych dla pacjentów opornych na leczenie.
-
Lista zastosowań jest znacznie dłuższa, a potencjał optogenetyki niezwykle ekscytujący.
Dlaczego Nie Słyszymy o Tym Więcej? Wyzwania i Ograniczenia
Skoro technika ta powstała na początku XXI wieku, dlaczego nie zrewolucjonizowała jeszcze medycyny? Jak to często bywa z przełomowymi technologiami, optogenetyka napotyka na poważne ograniczenia, zwłaszcza gdy przechodzimy z badań in vitro (w laboratorium, na komórkach) do badań in vivo (w żywych organizmach).
Główne Przeszkody:
-
Terapia Genowa:
-
Wprowadzenie genów: Aby neurony produkowały kanałorodopsyny, trzeba dostarczyć im odpowiedni materiał genetyczny. Najczęściej używa się do tego wektorów wirusowych (np. lentiwirusów lub wirusów związanych z adenowirusami – AAV).
-
Ryzyko: Lentiwirusy mogą być genotoksyczne i potencjalnie powodować raka. Ich insercja jest losowa, co również niesie ryzyko. Nowsze wektory AAV są bezpieczniejsze, ale głównym wyzwaniem jest pokonanie układu odpornościowego.
-
Koszty i produkcja: Terapia genowa jest droga i zindywidualizowana, co utrudnia masową produkcję i sprawia, że firmy farmaceutyczne niechętnie inwestują w rozwój takich terapii.
-
-
Dostarczenie Światła do Wnętrza Ciała:
-
Inwazyjność: O ile w przypadku leczenia ślepoty światło można dostarczyć przez oko za pomocą specjalnych gogli, o tyle w innych częściach ciała jest to znacznie trudniejsze. W modelach zwierzęcych (np. myszach) można wszczepić światłowody podłączone do diod LED przez otwór w czaszce. U ludzi takie rozwiązania są wysoce inwazyjne i mało praktyczne.
-
Problemy techniczne: Wszczepione światłowody mogą podrażniać tkanki (np. w sercu, powodując arytmie). Urządzenia emitujące światło wymagają zasilania (baterii), a ich wymiana wiąże się z kolejną operacją. Diody LED mogą się nagrzewać, co jest szkodliwe dla tkanki mózgowej.
-
Fizyka światła: Światło przechodzące przez tkanki ulega rozproszeniu, co zmienia jego ścieżkę i długość fali. To problem, bo kanałorodopsyny wymagają precyzyjnego celowania i określonej długości fali światła. Aby to skompensować, trzeba by wysyłać intensywniejsze światło, co zwiększa ryzyko przegrzania i uszkodzenia tkanki.
-
-
Utrzymanie Terapii:
-
Długoterminowość: Terapia optogenetyczna jest terapią długoterminową. Ekspresja kanałorodopsyn może spadać z czasem, a urządzenia emitujące światło mogą ulegać awariom lub wymagać ładowania/wymiany.
-
Wygaszanie genów: Geny wprowadzone za pomocą terapii genowej mogą być „wyciszane” przez mechanizmy komórkowe (np. metylację DNA).
-
Konieczność ponownych dawek/interwencji: Aby utrzymać terapeutyczny poziom kanałorodopsyn lub naprawić urządzenia, konieczne mogą być kolejne, ryzykowne interwencje.
-
Trudności z przerwaniem terapii: Terapie genowe są z założenia trwałe. Jeśli pacjent zdecyduje się przerwać leczenie, objawy mogą powrócić, a nawet się nasilić, ponieważ mózg mógł się zaadaptować do stymulacji.
-
Jak Pokonać Przeszkody? Nadzieja w Postępie Naukowym
Mimo tych wyzwań, naukowcy intensywnie pracują nad rozwiązaniami:
-
Terapia Genowa:
-
Omijanie układu odpornościowego: Stosuje się techniki podobne do tych przy transplantacjach organów (np. plazmafereza do usuwania przeciwciał anty-AAV, leki immunosupresyjne).
-
Modyfikacja wektorów AAV: Tworzy się wektory z mniejszą liczbą motywów CpG (częściej występujących u patogenów), co minimalizuje odpowiedź immunologiczną.
-
-
Urządzenia Emitujące Światło:
-
Mniej inwazyjne konstrukcje: Projektuje się urządzenia, w których baterie i inne komponenty wymagające naprawy znajdują się na zewnątrz ciała, a światło jest przesyłane do neuronów za pomocą światłowodów.
-
Sondy MicroLED: Elastyczne, krzemowe matryce microLED można wszczepiać minimalnie inwazyjnie (np. tuż pod czaszką), co zmniejsza ryzyko uszkodzenia tkanki mózgowej i redukuje rozpraszanie światła.
-
-
Inżynieria Kanałorodopsyn:
-
Odkrywanie nowych typów: Poszukuje się kanałorodopsyn bardziej efektywnych do różnych celów (np. absorbujących światło czerwone, które lepiej penetruje tkanki).
-
Uczenie maszynowe: Wykorzystuje się AI do projektowania kanałorodopsyn wymagających mniej światła do aktywacji, co minimalizuje nagrzewanie tkanki.
-
Badania strukturalne: Analizuje się budowę kanałorodopsyn, aby zrozumieć, jak poprawić ich szybkość i wydajność.
-
Jedynym poważnym problemem, który może opóźnić postęp, jest ekonomiczny aspekt terapii genowej. Istnieje jednak nadzieja, że rozwój narzędzi AI w biologii pozwoli zoptymalizować produkcję na tyle, by stała się ona bardziej opłacalna.
Czy Gra Jest Warta Świeczki?
Biorąc pod uwagę wszystkie trudności, można by zapytać, czy optogenetyka jest warta wysiłku. Autor artykułu uważa, że tak, głównie ze względu na kluczowe przewagi nad innymi technikami neuromodulacji, takimi jak chemogenetyka (aktywacja kanałów jonowych przez wiązanie małych cząsteczek do specjalnie zaprojektowanych receptorów) i magnetogenetyka (mechaniczne otwieranie kanałów jonowych za pomocą pól magnetycznych).
Przewagi Optogenetyki:
-
Rozdzielczość czasowa i przestrzenna: Optogenetyka oferuje znacznie większą precyzję w czasie (femtosekundy) i przestrzeni niż chemogenetyka czy magnetogenetyka.
-
Mniejsze ryzyko efektów ubocznych (off-target): Światło jest bardziej precyzyjnym bodźcem niż związki chemiczne (które mogą wpływać na inne receptory) czy pola magnetyczne (które mogą zakłócać działanie urządzeń elektronicznych w ciele lub indukować niepożądane napięcia w innych komórkach).
Jednak inne techniki mają swoje zalety – chemogenetyka i magnetogenetyka są niemal całkowicie nieinwazyjne chirurgicznie.
Podsumowanie: Świetlana Przyszłość (z Cierpliwością)
Optogenetyka to niezwykle ważna technika z ogromnym potencjałem do szerokiego zastosowania klinicznego, zwłaszcza tam, gdzie można ją stosować najmniej inwazyjnie (np. w leczeniu chorób oczu). Choć napotyka na liczne wyzwania, intensywne badania nad ich przezwyciężeniem dają nadzieję na przyszłość. Prawdopodobnie optogenetyka, w połączeniu z innymi technikami bioinżynieryjnymi, takimi jak chemogenetyka i magnetogenetyka, będzie stanowić część rozbudowanego zestawu narzędzi do neuromodulacji, pozwalając na wybór najlepszej metody w zależności od konkretnej sytuacji. Zmiana świata za pomocą optogenetyki jest możliwa, ale – jak to często bywa w nauce – będzie wymagała czasu i cierpliwości.
Optogenetyka: Jak Światło Może Leczyć Mózg – Rewolucja z Przeszkodami by www.doktoraty.pl