🎯 Potrzebujesz kwerendy | koncepcji | metodologii ? a może raportu | analizy | badań ?
Zamów profesjonalny deep research, który oszczędzi Ci setki godzin, pokaże Twój unikalny wkład w naukę i zapewni 100% pewności, że Twoja praca naukowa / publikacja / badanie jest kompletna/y i oryginalna/e.
👉 Kliknij i porozmawiaj z ekspertem – pierwszy krok nic nie kosztuje.
Żyjemy w epoce biologii. W ciągu zaledwie dekady byliśmy świadkami rewolucji, która na zawsze zmieniła medycynę i biotechnologię. Mowa o technologii CRISPR – systemie, który pozwala na precyzyjne „programowanie” genomu. Jej odkrycie w 2012 roku było wydarzeniem czysto akademickim, ale już w listopadzie 2023 roku doprowadziło do zatwierdzenia pierwszej terapii komórkowej opartej na CRISPR, leku Casgevy na choroby krwi. To bezprecedensowe tempo – zaledwie 11 lat od publikacji naukowej do leku ratującego życie, podczas gdy standardowy cykl rozwoju leków trwa 10-15 lat.
Ta historia pokazuje coś więcej niż tylko szybkość postępu. CRISPR to nie jest pojedyncze narzędzie, ale fundament całego drzewa technologicznego. To technologia ogólnego przeznaczenia, podobnie jak kiedyś tranzystor czy internet, która otwiera zupełnie nowe możliwości inżynierii biologicznej. Każdego tygodnia pojawiają się nowe odkrycia, które rozszerzają nasz zestaw narzędzi do programowania życia. Zrozumienie tych narzędzi jest kluczowe, ponieważ to one będą kształtować medycynę, rolnictwo i przemysł w nadchodzących dekadach. To one decydują o tym, jak szybko będziemy w stanie leczyć choroby genetyczne i tworzyć nowe, zrównoważone technologie.
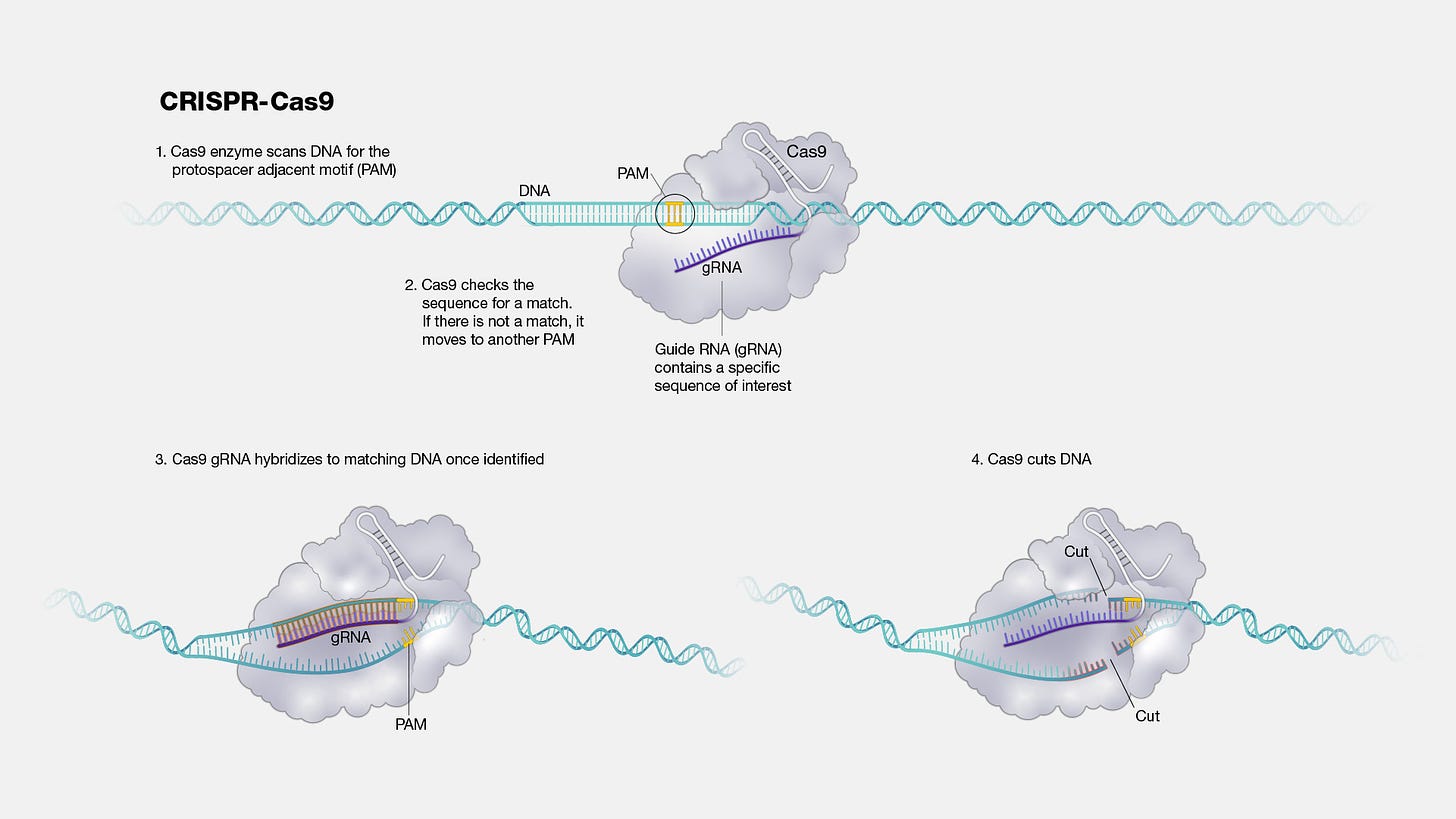
Nowy arsenał: przegląd najnowszych narzędzi do programowania biologii
W ostatnich tygodniach byliśmy świadkami prawdziwej eksplozji innowacji. Poniżej przedstawiamy przegląd kilku przełomowych technologii, które pokazują, jak dynamicznie rozwija się ta dziedzina.
1. HACE – ciągła mutageneza na zawołanie
Genetyka człowieka opiera się na fascynującym założeniu: natura sama przeprowadziła na nas eksperyment. Każda mutacja w ludzkiej populacji to test, który pokazuje, jaką rolę pełni dany fragment DNA. Dzięki sekwencjonowaniu możemy odczytywać wyniki tych naturalnych eksperymentów. A co, jeśli moglibyśmy sami generować i testować takie warianty w laboratorium na masową skalę?

Technologia HACE (Helicase-assisted continuous editing), opisana niedawno w preprincie, na to pozwala. Działa ona w następujący sposób:
-
Zmodyfikowany enzym Cas9, naprowadzany przez cząsteczkę RNA (sgRNA), dokonuje precyzyjnego, jednoniciowego nacięcia w DNA.
-
W miejscu nacięcia przyłącza się specjalny edytor HACE – jest to połączenie helikazy (enzymu „rozplatającego” DNA) i enzymu edytującego zasady.
-
Helikaza przesuwa się wzdłuż nici DNA, a przyłączony do niej edytor wprowadza po drodze losowe mutacje na określonym odcinku.
W efekcie uzyskujemy bibliotekę komórek z tysiącami różnych wariantów genetycznych w precyzyjnie wybranym rejonie genomu. To potężne narzędzie do badań funkcjonalnych – pozwala na szybkie mapowanie, jak poszczególne mutacje wpływają na przykład na oporność na leki czy działanie układu odpornościowego. To doskonały przykład na to, jak CRISPR z narzędzia do prostej edycji genów ewoluuje w platformę do zaawansowanej inżynierii.
2. Pisanie RNA – nowa granica inżynierii transkryptomu
Pierwsza fala rewolucji CRISPR skupiała się na edycji DNA – wprowadzaniu trwałych zmian w genomie. Jednak nie każda choroba wymaga permanentnej interwencji. Czasami potrzebujemy leku, który działa tymczasowo. Tu z pomocą przychodzi inżynieria transkryptomu, czyli edycja RNA – cząsteczek, które są „instrukcjami roboczymi” przepisywanymi z DNA.
W ciągu zaledwie jednego tygodnia opublikowano aż trzy niezależne prace opisujące nowe metody „pisania RNA” za pomocą trans-splicingu. Splicing to naturalny proces, w którym cząsteczka RNA jest „przycinana” i składana w ostateczną wersję przed translacją na białko. Trans-splicing to rzadkie zjawisko, w którym dwie oddzielne cząsteczki RNA są ze sobą łączone. Nowe technologie – RESPLICE, PRECISE i CRAFT – wykorzystują maszynerię CRISPR (głównie enzymy Cas13 i Cas7-11), aby ten proces kontrolować.

Jak to działa?
-
Jeden moduł systemu (oparty na Cas13 lub hybrydyzacji RNA) precyzyjnie naprowadza nową, „terapeutyczną” cząsteczkę RNA (zawierającą prawidłowy fragment genu) w pobliże docelowej, wadliwej cząsteczki RNA w komórce.
-
Drugi moduł (enzym Cas7-11) odcina niechciany, wadliwy fragment z docelowej cząsteczki RNA.
-
Naturalne mechanizmy komórkowe łączą (trans-splicing) terapeutyczny fragment z resztą cząsteczki, tworząc w pełni funkcjonalne RNA.
Potencjał jest ogromny: można w ten sposób naprawiać zmutowane białka, zastępować wadliwe fragmenty genów lub tworzyć zupełnie nowe białka fuzyjne – a wszystko to bez trwałych zmian w DNA. Fakt, że trzy czołowe laboratoria opublikowały te wyniki niemal jednocześnie, pokazuje, jak gorącym tematem jest pisanie RNA. To przestrzeń, którą warto obserwować, zwłaszcza że firmy takie jak Wave Life Sciences czy Amber Bio już komercjalizują podobne technologie.
3. Bridge RNA – trzecia generacja programowalnej biologii
Inżynieria biologiczna to w dużej mierze sztuka odkrywania. Potężne narzędzia do programowania biologii nie są przez nas wymyślane od zera – są ukryte w genomach bakterii i czekają na odkrycie. CRISPR jest tego najlepszym przykładem.
Niedawno naukowcy z Arc Institute, przeszukując gigantyczne bazy danych genomów bakteryjnych, dokonali kolejnego fascynującego odkrycia. Znaleźli rodzinę tzw. mobilnych elementów genetycznych (genów, które „skaczą” po genomie), które do swojego działania wykorzystują niezwykłe cząsteczki RNA, nazwane Bridge RNA (RNA pomostowe).
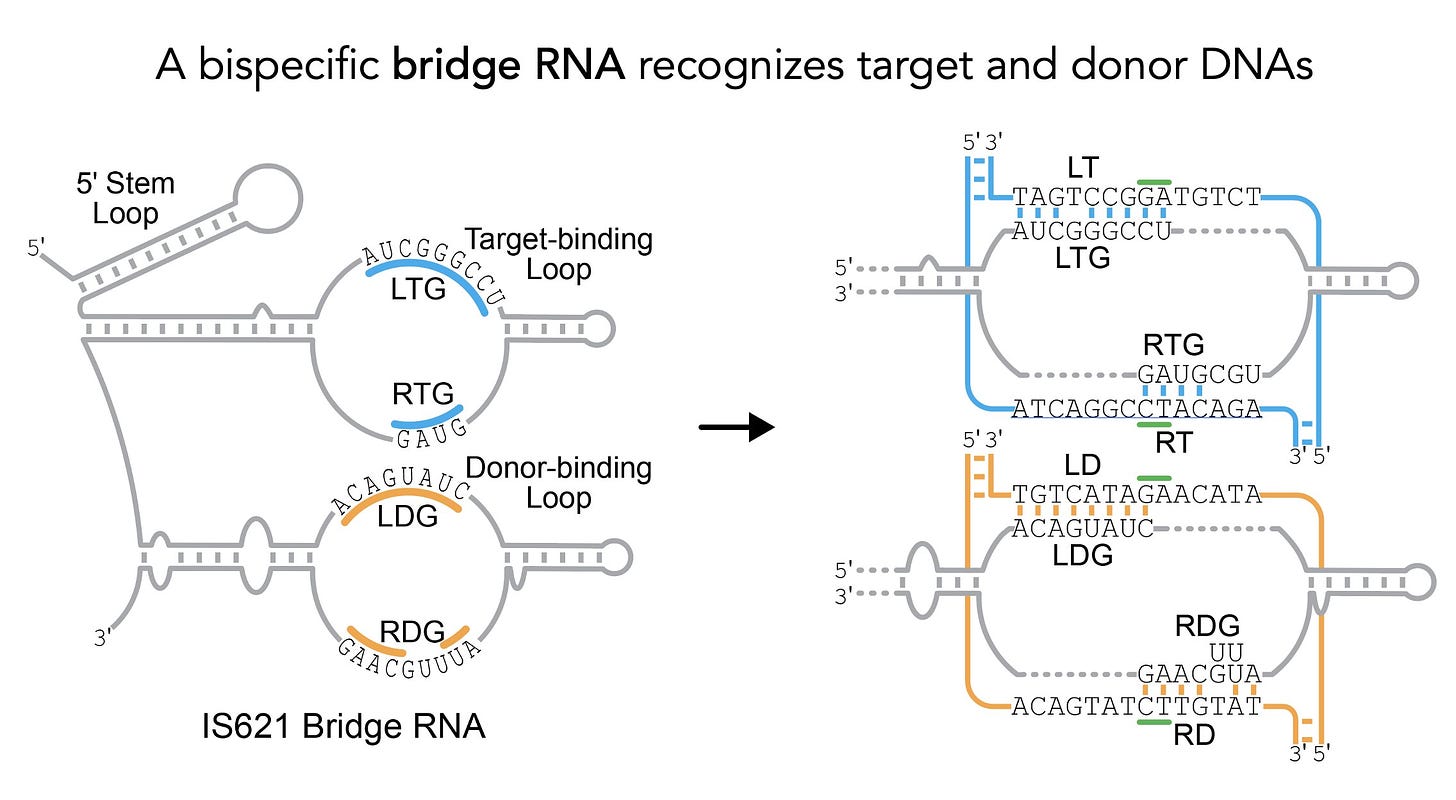
Te cząsteczki mają unikalną strukturę, która pozwala im jednocześnie rozpoznawać dwa różne fragmenty DNA – sekwencję docelową w genomie i sekwencję dawcy, która ma zostać wstawiona. Działają jak molekularny „most”, programując precyzyjne operacje, takie jak usuwanie, dodawanie lub odwracanie całych segmentów DNA. To fundamentalnie nowy mechanizm, który może pozwolić na manipulowanie dużymi fragmentami genomu w sposób dotychczas niemożliwy.
4. Więcej retronów – ukryte fabryki DNA
Retrony to kolejny przykład systemu odpornościowego bakterii, który możemy zaadaptować jako narzędzie biotechnologiczne. Działają one w niezwykły sposób: w odpowiedzi na infekcję wirusową, komórka bakteryjna masowo produkuje krótkie, jednoniciowe fragmenty DNA. Te fragmenty mogą służyć jako matryce do naprawy DNA w procesie edycji genów.

Zamiast dostarczać do komórki zewnętrzną matrycę naprawczą (co jest technicznie trudne), możemy za pomocą retronów zmusić komórkę, by sama ją wyprodukowała. Najnowsze badania, w których przetestowano ponad sto nowych, przewidzianych komputerowo sekwencji retronów, pokazały, że jest to niezwykle wydajna metoda. To piękny przykład synergii nowoczesnej nauki: Sekwencjonowanie DNA pozwoliło odkryć tysiące retronów, oprogramowanie (Software) pomogło przewidzieć ich funkcję, a Synteza DNA umożliwiła ich masowe testowanie na niespotykaną dotąd Skalę.
Spojrzenie w przyszłość: od modalności do modułowości terapeutycznej
Wszystkie te narzędzia prowadzą nas w jednym kierunku: ku przyszłości, w której medycyna staje się programowalna. Dziś mówimy o modalnościach terapeutycznych – określonych typach leków, jak małe cząsteczki czy przeciwciała. Każdy nowy lek wymaga wieloletnich, kosztownych badań.
Nowe narzędzia, takie jak CRISPR, otwierają perspektywę modułowości terapeutycznej. Wyobraźmy sobie system, w którym mamy gotową „platformę” lekową, a do leczenia nowej choroby wystarczy jedynie zmienić „oprogramowanie” – czyli sekwencję naprowadzającego RNA. Taki model zademonstrowała firma Intellia Therapeutics, której dwie terapie na zupełnie różne choroby różnią się tylko jedną cząsteczką – guide RNA.
Paradoksalnie, choć technologia ta wydaje się maszynką do drukowania pieniędzy, problemem pozostaje model biznesowy. Jak wyleczyć tysiące rzadkich chorób genetycznych, skoro opracowanie terapii dla każdej z nich, nawet na modularnej platformie, wciąż jest drogie? To pytanie o ekonomię biotechnologii pozostaje otwarte. Jedno jest jednak pewne: zestaw narzędzi do programowania biologii rośnie w oszałamiającym tempie, a my dopiero zaczynamy odkrywać jego pełen potencjał.
CRISPR to dopiero początek. Poznaj nowe narzędzia, które pozwalają programować życie. by www.doktoraty.pl