1. Wprowadzenie – dlaczego temat jest ważny?
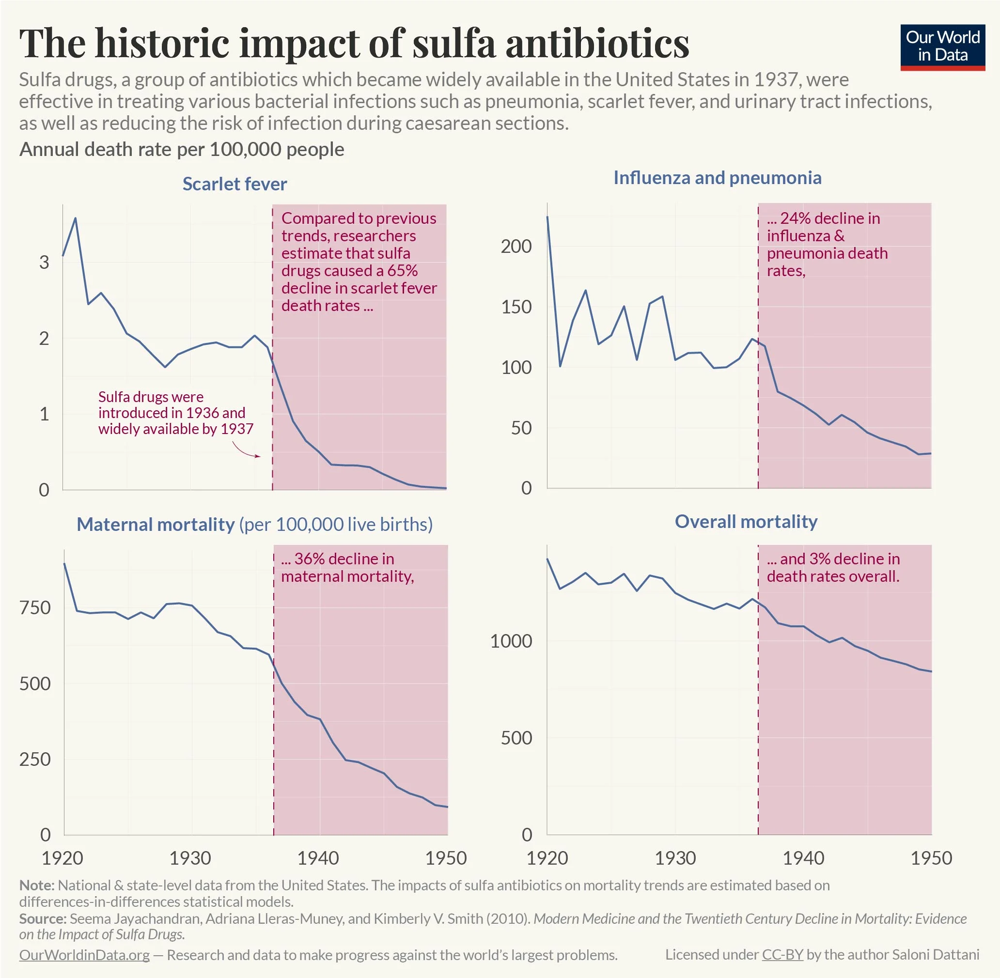
*Rys. 1: Wpływ wprowadzenia sulfonamidów (pierwszej grupy antybiotyków) na spadek umieralności z powodu infekcji (USA, lata 1920–1950).
Potrzebujesz rzetelnej analizy naukowej, badania lub raportu do swojego doktoratu, który zgłębi aktualne problemy zdrowia publicznego lub obali popularne mity? Zleć przygotowanie kompleksowego opracowania na dowolny temat, opartego na najnowszych danych i wiarygodnych źródłach. Skontaktuj się, aby omówić Twój projekt badawczy i otrzymać profesjonalną ekspertyzę!
- Ewolucja antybiotyków: odkrycie sulfonamidów i penicyliny zmieniło medycynę – dzięki nim spadły zgony na szkarlatynę, infekcje okołoporodowe, gruźlicę. Jednak z czasem nastąpił efekt uboczny – bakterie uodparniają się na leki.
- Skala nadużyć: Polska należy do krajów o jednym z najwyższych wskaźników stosowania antybiotyków w UE – ok. 22 DDD (defined daily doses) na 1000 mieszkańców/dzień wobec średnio 16,4 DDD w UE/EOG. Nadużywanie leków w populacji stwarza presję selekcyjną sprzyjającą oporności.
- Zagrożenie opornością: Według WHO oporność na antybiotyki to jedno z największych wyzwań zdrowotnych. W 2019 r. oporne bakterie spowodowały bezpośrednio ok. 1,27 mln zgonów na świecie. W samej UE/EOG infekcje oporne odpowiadają za ponad 35 tys. zgonów rocznie. Kontekst: bez powstrzymania tempa wzrostu oporności liczba zgonów może się dramatycznie zwiększyć.
- Narracja: Wyobraźmy sobie klasyczny scenariusz – pacjent z katarem idzie do lekarza i otrzymuje antybiotyk. Mimo że za kilka dni wyzdrowiał, uważa, że „lek zadziałał” – nie wiedząc, że najprawdopodobniej i tak wróciłby do zdrowia, a antybiotyk pomógłby ewentualnie bakteriom zdobyć odporność. Celem artykułu jest pokazanie, dlaczego takie przekonania są błędne i jakie niesie to konsekwencje.
2. Mit 1: „Antybiotyki działają na wszystko”

Rys. 2: Porównanie właściwości wirusów i bakterii – wirusy potrzebują żywego gospodarza, często mutują, podczas gdy bakterie mogą żyć samodzielnie i mają własną ścianę komórkową. Antybiotyki (np. beta-laktamy) zakłócają syntezę ściany bakteryjnej.
- Różnice bakteriowo–wirusowe: Bakterie to jednokomórkowce z własnym metabolizmem (mają np. ścianę komórkową), natomiast wirusy to niesamodzielne cząstki (jedyne „żywe” wewnątrz komórki gospodarza). Antybiotyki np. beta-laktamowe niszczą enzymy budujące ścianę bakteryjną. Wirusy nie posiadają ściany bakteryjnej ani typowych procesów metabolicznych antybiotyków – stąd na infekcje wirusowe antybiotykami nie działają.
- Przykłady infekcji: Typowe przeziębienie, grypa, większość kaszlu czy infekcji gardła to choroby wirusowe. Jak podkreśla VA (weterani US), „antybiotyki leczą tylko infekcje bakteryjne. Wirusy wywołują infekcje takie jak przeziębienie”. To samo stwierdzają badania Cochrane: „przeziębienie jest wywoływane przez wirusy, które nie reagują na antybiotyki”.
- Mechanizm działania antybiotyków: Wszystkie beta-laktamy wiążą się i inaktywują enzymy syntezujące ścianę bakteryjną, a inne klasy (makrolidy, aminoglikozydy itp.) hamują syntezę białek bakteryjnych. Nie mają jednak „punktu uchwytu” wewnątrz wirusa (który replikują się w komórce gospodarza). Dlatego mówi się, że „antybiotyki działają na bakterie, nie na wirusy”.
- Skutki mitycznego podejścia: Użycie antybiotyku „na wszelki wypadek” w infekcji wirusowej osłabia tylko mikroflorę, nie przyspiesza wyleczenia. Pamiętajmy, że stosowanie antybiotyków bez potrzeby to droga do oporności (patrz niżej).
3. Mit 2: „Przeziębienie lub grypa wymagają antybiotyku”
- Etiologia przeziębienia i grypy: Przeziębienie i większość grypopodobnych infekcji wywołują wirusy (np. rhinowirusy, koronawirusy, wirusy grypy). Antybiotyk nie zlikwiduje wirusa. Cochrane podsumowuje badania: „Brak dowodów na korzyść antybiotyków w leczeniu przeziębienia lub zatok u dzieci i dorosłych, a wiele osób doświadcza skutków ubocznych”.
- Dane epidemiologiczne: Według CDC 90–98% przypadków ostrego zapalenia zatok jest wirusowych, nawet jeśli zmiany pojawiają się pod koniec infekcji. Rutynowe podawanie antybiotyków przy zapaleniu oskrzeli bez przewlekłej choroby płuc nie jest zalecane.
- Zalecenia kliniczne: Wytyczne (CDC, WHO) odradzają antybiotykoterapię w „zwykłym” przeziębieniu czy grypie. Pamiętajmy: nie każda zielona wydzielina z nosa to bakteria! Lekarze powinni zalecić leczenie objawowe i ewentualnie testować pacjenta (np. na paciorkowca w gardle) przed przepisaniem antybiotyku. Nadmierne przepisywanie antybiotyków przy infekcjach wirusowych przyczynia się do narastania oporności, nie poprawiając samopoczucia pacjenta.
- Świadomość społeczna: Niestety wielu pacjentów nadal uważa, że „antybiotyk szybko wyleczy anginę czy gorączkę”. Edukacja jest kluczowa – antybiotyk nie zadziała na wirusa grypy, a może zaszkodzić (patrz niżej).
4. Mit 3: „Skoro mi pomogło, to musiało zadziałać”
- Efekt leku a naturalny przebieg choroby: Większość łagodnych infekcji wirusowych mija samoistnie w ciągu kilku dni. Pacjent przyjmuje antybiotyk i objawy ustępują za kilka dni – ale równie dobrze tak by było bez leku. Mówiąc inaczej, ergo propter hoc: wyzdrowiałeś – więc „musiał zadziałać antybiotyk” – to błąd logiczny. Badania pokazują, że przeziębienie trwa określoną liczbę dni niezależnie od antybiotyków.
- Efekt placebo i oczekiwania: W eksperymencie kontrolowanym okazało się, że pacjenci losowo przydzieleni do grupy bez podawania jakichkolwiek tabletek mieli dłuższy i cięższy przebieg niż ci, którym podano jakąkolwiek pigułkę (nawet placebo). W badaniu nad przeziębieniem chorym, którzy wierzyli w skuteczność terapii, choroba była krótsza niezależnie od tego, czy przyjmowali lek czynny czy placebo. Oznacza to, że samo podanie leku (nawet bez substancji aktywnej) i wiara w jego działanie może poprawić subiektywne odczucie zdrowienia.
- Błąd przypisywania skuteczności: Jeśli po antybiotyku poczułeś się lepiej, mogło to być naturalną kolejnością: symptomy wirusowego przeziębienia zwykle ustępują w ciągu 7–10 dni. Inna możliwość to tzw. regresja do średniej – objawy zazwyczaj nasilają się przez pierwsze 2–3 dni infekcji, potem stopniowo słabną niezależnie od leczenia. Blok „Antybiotyki na wirusy”: jak podkreśla VA, „antybiotyki nie wyleczą wirusowej infekcji. One… po prostu nie pomagają – choroba minie sama w tydzień lub dwa”.
- Edukacja pacjenta: Ważne, by pamiętać – subiektywne poczucie, że „antybiotyk pomógł”, może być mylące. Bezpieczniej przyjąć, że to przebieg choroby był przyczyną wyzdrowienia, a nie zażyty lek.
5. Mit 4: „Nie zaszkodzi, a może pomoże”
- Ryzyko działań niepożądanych: Każdy lek ma skutki uboczne. Antybiotyki (szczególnie doustne) często wywołują nudności, biegunkę czy wysypki. Zabijają też pożyteczną mikroflorę jelitową – może to prowadzić do bólu brzucha, biegunek, nadkażeń grzybiczych (drożdżyca). Sekcja „Używanie antybiotyków może…: daje obrzydzenie bądź biegunkę i infekcje grzybicze” z instytucji VA jest tu wymowna.
- Zaburzenia mikrobioty: Antibiotykoterapia radykalnie zmienia skład flory bakteryjnej jelit – obniża różnorodność szczepów i sprzyja zasiedleniu opornymi klonami. W efekcie nie tylko wzrasta ryzyko biegunki poantybiotykowej, ale może dochodzić do ciężkich infekcji Clostridioides difficile, który zyskuje przewagę po „wyjałowieniu” jelit przez inne bakterie. Długoterminowo niewłaściwa antybiotykoterapia może mieć też wpływ na układ odpornościowy czy metabolizm pacjenta (badania wskazują np. związek wczesnej ekspozycji na antybiotyk z ryzykiem alergii czy nadwagi).
- Alergie i powikłania: Istnieje też ryzyko reakcji uczuleniowych – od łagodnych wysypek po zagrażającą życiu anafilaksję. Choć ciężkie wstrząsy anafilaktyczne na antybiotyki zdarzają rzadko, warto o nich pamiętać. Antybiotyk może też wywołać zaburzenia wątroby lub uszkodzenie nerek, zwłaszcza u osób z chorobami przewlekłymi.
- Nadwyżka antybiotyków to kłopot: Dodatkowo składowanie w domu niewykorzystanych antybiotyków sprzyja samoleczeniu i dzieleniu się lekami – to wszystko zwiększa presję oporności. Zdrowiej jest nie zostawiać „leku na później” i przyjmować antybiotyk tylko zgodnie z zaleceniem lekarza.
6. Mit 5: „Jak nie dokończę kuracji, to będę bardziej odporny”
- Błąd rozumowania: Często słyszymy, że należy „dokończyć antybiotyk, bo inaczej bakterie się uodpornią” – czyli rzekomo pacjent sam stanie się odporny. To nie do końca prawda. Oporność rozwijają bakterie, nie my. Przerywanie terapii z czasem powoduje, że przetrwają te bakterie, które są mniej wrażliwe na lek, co sprzyja powstaniu szczepów odporniejszych.
- Zalecenia WHO: Najnowsze badania zmieniają zalecenia: krótszy, celowany kurs antybiotyku może być równie skuteczny jak długi i powodować mniej szkód. WHO wskazuje, że „krótsze kursy antybiotyków są często wystarczające – łatwiej je wykonać, wywołują mniej skutków ubocznych i zmniejszają ekspozycję bakterii na lek, a więc ograniczają tempo powstawania oporności”. Innymi słowy, jeśli lekarz zaleci 5 dni, to nie ma potrzeby przyjmować leku dłużej “na wszelki wypadek”.
- Zaufaj ekspertom: Jednak uczciwie trzeba dodać – decyzję o długości terapii zostawia się lekarzowi. Fakt, że czujemy się lepiej, nie oznacza, że wszystkie bakterie zostały pokonane. Dlatego warto skończyć przepisany kurs, ale jednocześnie nie przedłużać go bez potrzeby. Reklamowe hasło „dokończ kurację, nie stwarzaj oporności” jest teraz dyskutowane, lecz kluczowa pozostaje świadomość: niewłaściwe stosowanie (zarówno zbyt krótki jak i zbyt długi) może sprzyjać doborowi opornych szczepów.
7. Czym jest antybiotykooporność?
- Definicja: Oporność bakterii to utrata przez nie wrażliwości na lek. Bakterie naturalnie (wrodzenie) bywają niewrażliwe na niektóre antybiotyki, ale groźne jest nabyte przejmowanie oporności – kiedy wcześniej podatne na leczenie szczepy mutują lub dostają geny oporności, i przestają reagować na leki. Takie zakażenia trwają dłużej i częściej kończą się powikłaniami lub śmiercią.
- Mechanizmy: Bakterie mogą neutralizować antybiotyk enzymami (beta-laktamazy rozrywają pierścień beta-laktamowy), zmieniać miejsce docelowe (np. MRSA posiada zmodyfikowany enzym wiążący penicylinę), pompować lek na zewnątrz (eflux-pompy) lub zmieniać przepuszczalność błony. To biologiczne narzędzia, by antybiotyk nie zadziałał.
- Transfer genów: Kluczowe dla rozprzestrzeniania oporności jest horyzontalny transfer genów – bakterie mogą dzielić się plazmidami zawierającymi geny oporności nawet z innymi gatunkami. Dzięki temu szczepy multidrug-resistant (MDR) i extensively-drug-resistant (XDR) powstają szybciej niż samoistna mutacja. Wiele „superbakarii” ma zestaw genów odporności na wiele klas antybiotyków właśnie na plazmidach.
- Skala problemu: WHO szacuje, że do 2050 r. infekcje oporne zabiją więcej ludzi niż rak – może to być ~10 mln zgonów rocznie (dane oparte na prognozach WHO). Już dziś Światowa Organizacja zdrowia alarmuje, że coraz częściej pojawiają się szczepy oporne nawet na ostatnią deskę ratunku (np. XDR-TB, karbapenemooporne Enterobacterales, superrzeżączka oporna na ceftriakson). Za kilka lat może brakować skutecznych leków na zwykłe infekcje.
- MDR i XDR: Podsumowując, MDR (wielooporne) to bakterie oporne na ≥3 różne klasy antybiotyków; XDR – oporne na wszystkie dostęne leki poza maksymalnie dwoma klasami. Przykład: K. pneumoniae produkujące KPC lub NDM są oporne na większość antybiotyków i są praktycznie „nietykalne”.
8. Przykłady z życia: kiedy antybiotyk naprawdę nie działa
- Dane globalne: Już około 2019 Lancet szacował, że oporne bakterie były bezpośrednią przyczyną ~1,27 mln zgonów rocznie. W USA CDC odnotowuje co roku ponad 2,8 mln infekcji bakteriami opornymi i ~35 tys. zgonów z tego powodu (po dodaniu zakażeń Clostridioides difficile – nawet 48 tys. zgonów). W samej Europie ECDC-estimacje za rok 2020 mówią o ok. 800 tys. infekcji opornymi drobnoustrojami rejestrowanymi w sieci EARS-Net, z czego 35 tys. zgonów.
- Przykłady szczepów: Najczęściej problem tworzą odporne patogeny szpitalne i środowiskowe:
- Staphylococcus aureus oporny na metycylinę (MRSA) – kiedyś rzadko spotykany poza szpitalami, dziś wciąż około 15–30% szczepów jest opornych.
- Enterococcus faecium oporny na wankomycynę (VRE) – coraz częstsze wśród pacjentów szpitalnych.
- Gram-ujemne Enterobacterales (np. E. coli, Klebsiella) oporne na 3. generację cefalosporyn (ESBL) i na karbapenemy – globalnie rosnące liczby. Przykładowo w UE oporność karbapenemowa K. pneumoniae wzrosła o ok. 50% między 2019 a 2022 r., odlegając od celów redukcji.
- Pseudomonas aeruginosa i Acinetobacter baumannii oporne na karbapenemy – „superbugs” z oddziałów intensywnej terapii.
- Neisseria gonorrhoeae – wysoce oporna na fluorochinolony, azytromycynę, a od niedawna pojawiają się przypadki odporne także na ceftriakson (tzw. super-rzeżączka).
- Skutki praktyczne: Przekłada się to na sytuacje kliniczne: np. rośnie odsetek pacjentów z zapaleniem płuc lekoopornym na standardowe leczenie, coraz częściej potrzeba stosować bardzo silne i drogie leki ratunkowe. Według danych ECDC/EARS-Net, w 2020 r. ponad 35 tys. ludzi w Europie zmarło „na oporne infekcje”. W Polsce co roku zgłaszane są przypadki zakażeń szczepami XDR-TB, pojawiają się doniesienia o zakażeniach z Klebsiella NDM czy KPC, a w moczu pacjentów na oddziałach internistycznych coraz częściej rosną odsetki szczepów opornych nawet na karbapenemy.
9. Rola społeczeństwa i lekarzy w walce z antybiotykoopornością
- Edukacja i świadomość: Kluczowa jest informacja zarówno pacjentów, jak i personelu medycznego. Każdy powinien wiedzieć, że antybiotyk przepisuje się dopiero po potwierdzeniu wskazań. Kampanie społeczne (np. Europejski Dzień Wiedzy o Antybiotykach) uczą, żeby nie domagać się leku „na przeziębienie”.
- Antibiotic stewardship (racjonalne przepisywanie): Szpitale i przychodnie wdrażają programy racjonalizacji użycia antybiotyków. WHO zaleca edukowanie lekarzy, pielęgniarek i farmaceutów do stosowania się do wytycznych opartej na dowodach, co minimalizuje nadmierne przepisywanie. Przykładem jest klasyfikacja AWaRe WHO, która promuje leki wąskospektralne („Access”) jako pierwszoliniowe.
- One Health: Współpraca sektorów zdrowia ludzi, weterynarii i ochrony środowiska. Ograniczenie antybiotyków w hodowli zwierząt zmniejsza nacisk selekcyjny. Polityki rządowe zakazujące sprzedaży antybiotyków bez recepty (jak w Polsce) oraz programy monitorujące zużycie leków służą celom walki z opornością.
- Odpowiedzialność pacjenta: Jako obywatele powinniśmy zaufanie do lekarza; stosować się do zaleceń („biorę antybiotyk tylko wtedy, gdy lekarz wyraźnie zalecił i przepisuje konkretną dawkę i czas”) oraz dbać o profilaktykę (szczepienia, higiena). Nieprzechowywanie i niewymienianie przeterminowanych antybiotyków zapobiega ich niewłaściwemu użyciu w przyszłości.
- Kształcenie personelu medycznego: WHO podkreśla, że edukacja kadr medycznych to fundament prewencji oporności. Informowanie lekarzy o lokalnych danych epidemiologicznych (które bakterie są oporne w danym regionie) pomaga w wybieraniu najbezpieczniejszych terapii.
10. Co możemy zrobić? (Rekomendacje dla obywateli)
- Profilaktyka infekcji: Szczepienia przeciw grypie i pneumokokom zmniejszają zachorowalność, co bezpośrednio ogranicza potrzebę użycia antybiotyków. Meta-analiza wskazuje, że osoby zaszczepione przeciw grypie o ok. 30–37% rzadziej otrzymywały antybiotyk na infekcje oddechowe.
- Higiena osobista: Częste mycie rąk, zasłanianie ust przy kichaniu i kaszlu, wietrzenie pomieszczeń – to proste działania redukujące rozprzestrzenianie się zarazków. Mniej infekcji to mniejsza presja na stosowanie leków.
- Konsultacja lekarska zamiast samoleczenia: Przy objawach choroby lepiej skontaktować się z lekarzem niż samemu brać „tabletki z apteczki”. Lekarz potrafi ocenić, czy infekcja jest prawdopodobnie bakteryjna (wymaga antybiotyku), czy wirusowa. Zapytaj w aptece o doradztwo, ale unikaj zakupu antybiotyków bez recepty (to zabronione w Polsce).
- Stosowanie się do zaleceń lekarskich: Jeśli lekarz przepisał antybiotyk, należy go przyjmować zgodnie z instrukcją (odpowiednia dawka, odstępy) i tylko przez zalecany czas. Nie przerywaj kuracji od razu po polepszeniu, ale też nie wydłużaj jej „na wszelki wypadek” bez konsultacji (patrz Sekcja 6).
- Promocja wiedzy w środowisku: Dzielmy się wiedzą – rozmawiajmy w rodzinie, w pracy, na portalach społecznościowych o tym, że antybiotyki to nie cukierki. Wspieranie lokalnych kampanii edukacyjnych czy wolontariat w akcjach zdrowotnych – to także wkład obywatela.
- Rozwój infrastruktury zdrowotnej: Zgłaszajmy się na szczepienia sezonowe i regularne badania kontrolne (profilaktyka), aby zapobiegać chorobom, które mogłyby wymagać antybiotyków.
11. Podsumowanie i wezwanie do działania
- Rekapitulacja mitów: Przeanalizowaliśmy pięć powszechnych mitów. Antybiotyki nie leczą wirusów (wiemy, że „na przeziębienie” nie pomogą), ich pozorne „działanie” często wynika z naturalnego wyzdrowienia, a każde niepotrzebne podanie niesie ryzyko (od skutków ubocznych po przyspieszoną oporność).
- Skutki nadużywania: Oporność to już nie abstrakcja – realnie oznacza trudniejsze leczenie zwykłych zakażeń, wzrost zgonów i koszty dla systemu opieki zdrowotnej. Bez zmian w zachowaniach grozi nam epoka „post-antybiotykowa”, w której codzienne infekcje stają się śmiertelne.
- Rola każdego z nas: Jako pacjenci możemy wpływać na ten trend: nie oczekujmy antybiotyku przy każdym katarze, edukujmy siebie i bliskich. Lekarze i system służby zdrowia muszą wspólnie dbać o racjonalne stosowanie leków i monitorować oporność. Władze powinny wspierać programy antynikotynowe i szczepienia oraz monitorować sprzedaż antybiotyków.
- Wezwanie do rozsądku: Dbajmy o antybiotyki jak o cenny skarb medycyny. Jeśli nie jest to absolutnie konieczne, nie bierzmy ich „na wszelki wypadek”. W naszych rękach jest przyszłość: świadome korzystanie z leków ochroni nas przed globalną epidemią bakterii „nieuleczalnych”. Razem możemy ograniczyć skalę problemu i przedłużyć skuteczność dostępnych antybiotyków.
Wybrane cytaty i źródła: W tekście użyto danych WHO, ECDC, CDC oraz recenzowanych źródeł naukowych. Przykładowo WHO podaje, że „nadużywanie środków przeciwdrobnoustrojowych jest główną przyczyną rozwoju drobnoustrojów opornych”, a Cochrane konkluduje brak korzyści z antybiotyków przy przeziębieniu. Wszystkie te informacje opierają się na badaniach i raportach (patrz cytowania).