Chirurgia raka prostaty: koniec z wróżeniem z fusów, czas na naukę i dane
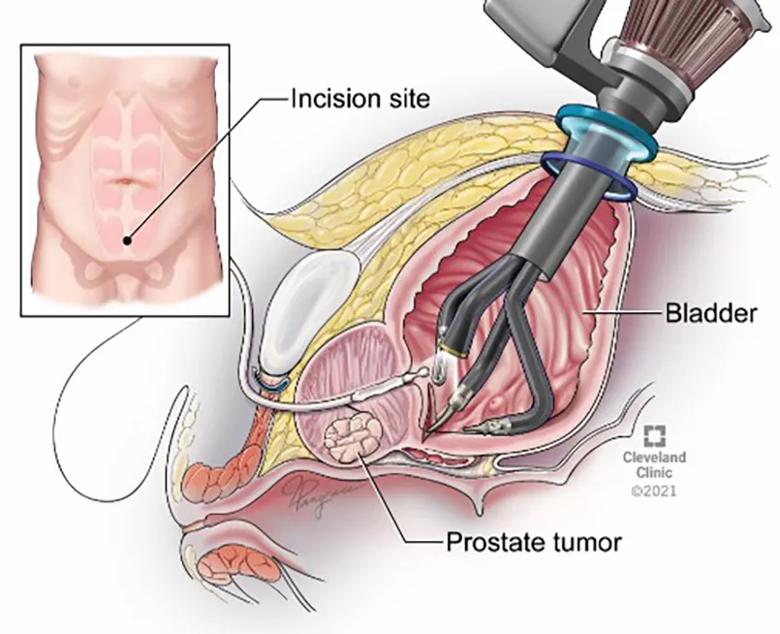
Diagnoza „rak prostaty” to dla każdego mężczyzny potężny cios. W głowie natychmiast pojawia się tysiąc pytań, a jedno z nich jest kluczowe: co dalej? W przypadku zlokalizowanego nowotworu, najczęstszą i najskuteczniejszą odpowiedzią jest operacja – radykalna prostatektomia, dziś najczęściej wykonywana z asystą robota. Ale ta operacja to dla chirurga niezwykle delikatny taniec na linie. Celem jest tzw. „złota trójka”:
-
Całkowite usunięcie raka (brak tzw. dodatnich marginesów chirurgicznych).
-
Zachowanie trzymania moczu.
-
Zachowanie funkcji seksualnych.
Osiągnięcie wszystkich trzech celów to święty Graal urologii onkologicznej. Przez lata chirurdzy polegali na swoim doświadczeniu, intuicji i standardowych, płaskich obrazach z rezonansu magnetycznego. Jednak jako naukowcy z 20-letnim stażem wiemy, że postęp nie rodzi się z intuicji, a z twardych danych i nieustannej refleksji. Dlatego rozpoczęliśmy program, który zamienia salę operacyjną w laboratorium, a wyniki pacjentów w bezcenną wiedzę, która pozwala nam być lepszymi z każdym kolejnym zabiegiem. Oto co odkryliśmy.
Od płaskiej mapy do holodeku: rewolucja w obrazowaniu przedoperacyjnym
Wyobraź sobie, że masz zaplanować precyzyjną misję wojskową, dysponując jedynie płaską, dwuwymiarową mapą. Widzisz kontury, ale nie rozumiesz w pełni terenu, jego głębi i ukrytych zagrożeń. Tak przez lata wyglądało planowanie operacji prostaty. Zwykły rezonans magnetyczny (MRI) jest bezcenny, ale to wciąż tylko seria płaskich obrazów. A przecież prostata to skomplikowana struktura 3D.
Dlatego postanowiliśmy pójść o krok dalej. Zaczęliśmy tworzyć indywidualne, wirtualne i drukowane w 3D modele prostaty dla każdego pacjenta. Wykorzystując specjalistyczne oprogramowanie, przekształcamy dane z MRI w precyzyjny, trójwymiarowy model, który chirurg może obejrzeć na tablecie, obracać w każdą stronę, a nawet wziąć do ręki. Widzi na nim nie tylko prostatę, ale i dokładną lokalizację oraz objętość guza.
Efekt? Zaskakujący. W naszych badaniach, po zapoznaniu się z modelem 3D, doświadczeni chirurdzy zmieniali swój pierwotny plan operacyjny w 25% przypadków! Nagle, dzięki lepszemu zrozumieniu przestrzennej relacji między guzem a kluczowymi strukturami (jak pęczki nerwowo-naczyniowe odpowiedzialne za erekcję), mogli zaplanować bardziej precyzyjne i bezpieczniejsze cięcie. Zgoda między chirurgami co do planu operacji znacząco wzrosła. To przejście od zgadywania do pewności.
Milimetry, które decydują o jakości życia
Ale sama wizualizacja to nie wszystko. Zaczęliśmy analizować dane, których nikt wcześniej nie mierzył w standaryzowany sposób. Jednym z kluczowych odkryć jest znaczenie długości cewki błoniastej (MUL) – niewielkiego odcinka cewki moczowej tuż pod prostatą. Okazało się, że ten parametr, mierzony na przedoperacyjnym MRI, jest potężnym predyktorem tego, jak szybko pacjent odzyska pełne trzymanie moczu.
Nasze badania pokazały, że nawet doświadczeni radiolodzy mogą różnić się w pomiarach nawet o 4 mm. To wydaje się niewiele, ale w skali tak małej struktury to przepaść. Dopiero opracowanie i wdrożenie ustandaryzowanej metody pomiaru pozwoliło nam uzyskać wysoką zgodność (ICC > 0.84), co czyni ten parametr wiarygodnym narzędziem do rozmowy z pacjentem o jego realnych szansach na szybki powrót do normalności.
Gra o marginesy: gdzie czai się ryzyko?
Największym koszmarem chirurga onkologicznego jest „dodatni margines chirurgiczny” – sytuacja, w której po wycięciu guza okazuje się, że komórki nowotworowe znajdują się na samej linii cięcia. To znacząco zwiększa ryzyko nawrotu choroby.
Nasze analizy wykazały, że guz zlokalizowany w szczycie prostaty (tzw. apeksie) jest niezależnym czynnikiem ryzyka dodatniego marginesu. To niezwykle ważna informacja, ponieważ szczyt prostaty to anatomicznie najtrudniejszy rejon, pozbawiony ochronnej torebki. Wiedząc, że guz znajduje się właśnie tam, chirurg może zaplanować szersze, bardziej radykalne cięcie w tym konkretnym miejscu, minimalizując ryzyko, jednocześnie starając się oszczędzić nerwy w innych rejonach.
| Lokalizacja guza | Ryzyko nawrotu biochemicznego |
| Guz w szczycie prostaty (widoczny w MRI) | 21% |
| Brak guza w szczycie prostaty | 4% |
| Hazard Ratio (HR) | 6.68 |
Dane mówią same za siebie. Pacjenci z guzem w szczycie prostaty mają prawie 7-krotnie wyższe ryzyko nawrotu. Identyfikacja tego faktu przed operacją jest absolutnie kluczowa.
Filozofia ciągłego doskonalenia: cykl PDCA w praktyce
Skąd biorą się te wszystkie odkrycia? Z systematycznego podejścia, które zapożyczyliśmy z przemysłu i inżynierii – cyklu PDCA (Plan-Do-Check-Act), czyli Planuj-Wykonaj-Sprawdź-Działaj.
-
Planuj: Identyfikujemy problem (np. zbyt wysoki odsetek dodatnich marginesów).
-
Wykonaj: Wprowadzamy zmianę w technice operacyjnej lub w planowaniu (np. obowiązkowe modele 3D dla guzów w szczycie).
-
Sprawdź: Przez kolejne 6-12 miesięcy zbieramy dane i analizujemy, czy zmiana przyniosła oczekiwany skutek.
-
Działaj: Jeśli wyniki są lepsze, nowa technika staje się standardem. Jeśli nie – wracamy do kroku 1 i szukamy innej przyczyny.
To nieustanny proces, w którym każdy pacjent i każda operacja to lekcja. To kultura, w której chirurdzy nie konkurują ze sobą, ale regularnie spotykają się, by w bezpiecznym, koleżeńskim gronie analizować swoje wyniki, oglądać nagrania z operacji i uczyć się od siebie nawzajem.
Co to oznacza dla pacjenta?
Oznacza to, że współczesna, zaawansowana opieka onkologiczna to coś więcej niż tylko nowoczesny robot i doświadczony chirurg. To cały system oparty na danych, który pozwala na:
-
Lepsze informowanie: Przed operacją pacjent może zobaczyć swój własny, trójwymiarowy model guza i zrozumieć, na czym polega ryzyko. Może też poznać swoje indywidualne, a nie uśrednione, szanse na powrót do zdrowia.
-
Spersonalizowane planowanie: Operacja jest „szyta na miarę”, z uwzględnieniem unikalnej anatomii i lokalizacji nowotworu.
-
Ciągłą poprawę: System opieki, do którego trafia pacjent, staje się z dnia na dzień coraz lepszy, bo uczy się na każdym, nawet najmniejszym, sukcesie i porażce.
To jest przyszłość medycyny, która dzieje się już dziś. To odejście od sztuki i intuicji na rzecz nauki, danych i mierzalnych wyników.
5 innych tematów, które zrealizowaliśmy w ramach naszych badań
-
PSMA PET/CT w diagnostyce pierwotnej: Analiza cech klinicznych rzadkich guzów prostaty, które nie są widoczne w nowoczesnym skanowaniu PET.
-
Zmniejszenie dyskomfortu pooperacyjnego: Badanie różnych strategii znieczulenia śródoperacyjnego w celu redukcji bólu i dyskomfortu związanego z cewnikiem.
-
Leczenie powikłań: Ocena długoterminowych wyników leczenia zwężeń cewki moczowej po operacji, z uwzględnieniem wpływu wcześniejszej radioterapii.
-
Predykcja wyników funkcjonalnych: Analiza, które czynniki – powikłania czy wyjściowa jakość życia – mają większy wpływ na samopoczucie pacjenta 6 miesięcy po operacji.
-
Walidacja nomogramów predykcyjnych: Testowanie i potwierdzanie skuteczności narzędzi, które na podstawie danych z biopsji i MRI przewidują ryzyko rozprzestrzenienia się raka poza prostatę.
Pomysł na doktorat
Tytuł: Randomizowane badanie kliniczne oceniające wpływ przedoperacyjnego planowania z użyciem wirtualnych i drukowanych modeli 3D na odsetek dodatnich marginesów chirurgicznych oraz wyniki funkcjonalne po prostatektomii radykalnej z asystą robota (badanie 3D-RARP).
Opis: Dotychczasowe badania nad modelami 3D w chirurgii prostaty miały charakter obserwacyjny lub obejmowały małe grupy. Brakuje dowodów najwyższej jakości (Poziom 1) z dużego, randomizowanego badania klinicznego (RCT). Projekt doktorancki polegałby na zaprojektowaniu i przeprowadzeniu takiego badania. Pacjenci kwalifikujący się do prostatektomii robotycznej byliby losowo przydzielani do jednej z dwóch grup: 1) Grupa kontrolna – planowanie operacji na podstawie standardowych danych klinicznych i obrazów MRI 2D. 2) Grupa badana – planowanie operacji z dodatkowym wykorzystaniem interaktywnego modelu 3D. Głównym punktem końcowym byłby odsetek dodatnich marginesów chirurgicznych. Drugorzędowe punkty końcowe obejmowałyby wyniki funkcjonalne (trzymanie moczu, funkcje seksualne) oceniane za pomocą walidowanych kwestionariuszy, czas operacji oraz satysfakcję chirurga. Taki doktorat dostarczyłby ostatecznych dowodów na kliniczną i potencjalnie ekonomiczną wartość tej technologii, co mogłoby doprowadzić do zmiany standardów opieki na całym świecie.