Streszczenie
Agoniści receptora GLP-1 – czyli leki naśladujące naturalny hormon inkretynowy odpowiedzialny za regulację poziomu cukru we krwi – robią furorę w medycynie metabolicznej. Początkowo stosowane głównie w leczeniu cukrzycy typu 2, szybko stały się jedną z najskuteczniejszych opcji także w terapii otyłości i wielu innych schorzeń. W ostatnich latach kolejne badania potwierdzają ich zdolność do nie tylko efektywnej kontroli glikemii, lecz także istotnego odchudzania i zmniejszania ryzyka sercowo-naczyniowego.
Jak to działa? Agoniści GLP-1 spowalniają opróżnianie żołądka i „mówią” mózgowi, że jesteśmy syci, co przekłada się na mniejszy apetyt. Jednocześnie podnoszą wydzielanie insuliny, gdy poziom cukru we krwi jest wysoki (co minimalizuje zagrożenie hipoglikemią), i hamują sekrecję glukagonu. W efekcie pacjenci nie tylko obniżają stężenie HbA1c, lecz także tracą na wadze – często nawet 10–15% wyjściowej masy ciała przy zastosowaniu nowocześniejszych preparatów, takich jak semaglutyd czy tirzepatyd. Badania kliniczne pokazały również wymierny spadek incydentów sercowo-naczyniowych (zawałów, udarów) u osób z cukrzycą i otyłością, a ostatnio udowodniono takie działanie także u osób bez cukrzycy. Ponadto analogi GLP-1 budzą nadzieję w leczeniu niealkoholowej stłuszczeniowej choroby wątroby (NAFLD), a kolejne triale analizują ich potencjał w niewydolności serca i innych schorzeniach metabolicznych.
Choć leki te są na ogół bezpieczne, trzeba pamiętać o typowych skutkach ubocznych, takich jak nudności czy biegunka, zwłaszcza przy zbyt szybkim zwiększaniu dawki. Niektóre osoby przerywają terapię z powodu kosztów lub dyskomfortu związanego z iniekcjami. Na szczęście rozwijane są nowe formy doustne oraz formuły wielohormonalne (jak tirzepatyd), które mogą zapewnić jeszcze lepsze wyniki w odchudzaniu i kontroli cukrzycy. Wszystko to sprawia, że agoniści GLP-1 reprezentują obecnie jeden z najbardziej fascynujących i obiecujących nurtów w leczeniu chorób metabolicznych.
- Mechanizm działania agonistów GLP-1 na poziomie molekularnym
Rola GLP-1 i lokalizacja receptorów: Glukagonopodobny peptyd-1 (GLP-1) to hormon inkretynowy wytwarzany w jelicie, trzustce (komórki α) oraz ośrodkowym układzie nerwowym. Jego receptory (GLP-1R) są szeroko rozmieszczone – występują na komórkach β trzustki, w przewodzie pokarmowym (m.in. żołądek), w ośrodkach mózgu (podwzgórze, pień mózgu) oraz w innych tkankach (serce, nerki) (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects) (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). Agoniści receptora GLP-1 są analogami GLP-1 lub związkami pobudzającymi GLP-1R, dzięki czemu naśladują działanie endogennego hormonu.
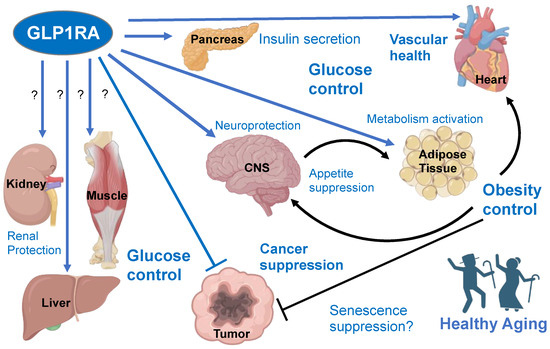
Wpływ na komórki β trzustki i glikemię: Pobudzenie GLP-1R na komórkach β trzustki uruchamia szlak z białkiem Gs i cyklicznym AMP, co nasila zależne od stężenia glukozy wydzielanie insuliny. Jednocześnie hamowana jest sekrecja glukagonu z komórek α trzustki (pośrednio przez efekty na komórki β/δ lub bezpośrednio – dowiedziono obecność GLP-1R także na komórkach α) (Glucagon-like Peptide-1: Actions and Influence on Pancreatic Hormone Function – PMC). W efekcie agoniści GLP-1 poprawiają poposiłkową i podstawową glikemię: zwiększają poposiłkowy wyrzut insuliny oraz zmniejszają nieadekwatnie wysokie stężenia glukagonu w hiperglikemii (GLP-1: Molecular mechanisms and outcomes of a complex signaling system – PMC). Dodatkowo chronią komórki β – badania wykazały spadek apoptozy i stymulację neogenezy wysp trzustkowych pod wpływem GLP-1 (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf) (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). Istotną cechą jest zależność insulinotropizmu od glukozy: aktywacja GLP-1R nie wywołuje nadmiernej insulinemi przy normoglikemii, co tłumaczy niski inherentny potencjał hipoglikemii tej klasy leków (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf).
Wpływ na ośrodkowy układ nerwowy i łaknienie: GLP-1 przenika przez barierę krew-mózg i oddziałuje na neurony m.in. podwzgórza (jądra łukowate, ośrodek sytości) oraz na ośrodek nagrody. Pobudzenie GLP-1R w mózgu zmniejsza odczuwanie głodu i hamuje apetyt, sprzyjając mniejszemu poborowi pokarmu i utracie masy ciała (GLP-1: Molecular mechanisms and outcomes of a complex signaling system – PMC) (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). Pacjenci zażywający agonistów GLP-1 często zgłaszają wcześniejsze poczucie sytości – mechanizm ten wiąże się z centralnym tłumieniem łaknienia oraz sygnałami z nerwu błędnego z przewodu pokarmowego. W badaniach przedklinicznych wykazano też neuroprotekcyjne właściwości agonistów GLP-1: redukcję procesów zapalnych w OUN, promowanie neurogenezy i poprawę plastyczności synaptycznej (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects) (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). Te obserwacje stały się podstawą do prób wykorzystania leków inkretynowych w chorobach neurodegeneracyjnych (omówione w rozdz. 5).
Wpływ na przewód pokarmowy: GLP-1R obecne są w żołądku i jelitach (oraz w splotach nerwowych jelitowych i aferentnych włóknach nerwu błędnego). Ich pobudzenie powoduje opóźnienie opróżniania żołądka i zmniejszenie wydzielania soków trawiennych (GLP-1: Molecular mechanisms and outcomes of a complex signaling system – PMC). Skutkiem jest wolniejsze wchłanianie glukozy i tłumienie poposiłkowych wahań glikemii. U pacjentów obserwuje się często zmniejszenie łaknienia i szybsze nasycenie posiłkiem, co częściowo wynika właśnie z zalegania pokarmu w żołądku. Działanie to przyczynia się do redukcji masy ciała, ale też leży u podłoża częstych efektów ubocznych ze strony GI (nudności, wymioty – patrz rozdz. 4).
Inne efekty biologiczne: Receptory GLP-1 zlokalizowane w różnych tkankach pośredniczą również w dodatkowych korzystnych działaniach: stwierdzono m.in. poprawę funkcji śródbłonka i wazodylatację, obniżenie ciśnienia tętniczego, wzrost diurezy natriuretycznej i korzystny wpływ na czynność mięśnia sercowego (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). W doświadczeniach odnotowano też przyspieszenie przemiany materii (aktywacja brunatnej tkanki tłuszczowej i zwiększony wydatek energetyczny) oraz poprawę profilu lipidowego (spadek triglicerydów, hamowanie stłuszczenia wątroby) (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). Te wielokierunkowe efekty sprawiają, że agoniści GLP-1 są badani w licznych wskazaniach pozaglikemicznych (omówionych w rozdz. 5 i 8).
🧠 Potrzebujesz podobnej analizy?
Jeśli ten raport był dla Ciebie wartościowy – wyobraź sobie, co możemy stworzyć na temat, który Cię naprawdę interesuje. Niezależnie od tego, czy potrzebujesz:
przeglądu literatury naukowej z konkretnego obszaru,
pogłębionej analizy klinicznej,
porównania skuteczności terapii,
albo syntetycznego raportu do publikacji lub prezentacji —
📩 Daj znać, czego szukasz, a przygotuję dla Ciebie raport badawczy klasy premium, dostosowany do Twoich potrzeb: dokładny, rzetelny i gotowy do wykorzystania.
👉 Czy chcesz zamówić podobny raport lub przegląd literatury z dowolnego obszaru medycyny, nauk biologicznych lub farmacji? Napisz mi, a zajmiemy się tym profesjonalnie.
- Zastosowania kliniczne: cukrzyca typu 2 i otyłość
Leczenie cukrzycy typu 2: Agoniści GLP-1 od ponad dekady stanowią ważną klasę leków hipoglikemizujących w cukrzycy typu 2. Liczne badania fazy III dowiodły ich wysokiej skuteczności w obniżaniu poziomu hemoglobiny glikowanej (HbA1c) – typowo o około 1–1,5 punktu procentowego (wartość bezwzględna) z poziomu wyjściowego, a w przypadku najsilniejszych analogów nawet do ~1,8% (Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial – PubMed) (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed). W metaanalizie z 2024 r. stwierdzono, że semaglutyd był najskuteczniejszym z dotychczasowych agonistów GLP-1, redukując HbA1c średnio o ~1,7%, przewyższając inne leki inkretynowe (Systematic review of the efficacy and safety of GLP-1 receptor agonists in the treatment of patients with type 2 diabetes mellitus). Jednocześnie leki te sprzyjają utracie masy ciała, co jest unikalną korzyścią w porównaniu do wielu tradycyjnych środków przeciwcukrzycowych. W kontrolowanych próbach klinicznych pacjenci z cukrzycą na agonistach GLP-1 tracili średnio 2–4 kg, a w przypadku potężniejszych cząsteczek (np. semaglutydu) nawet do ~5–6 kg w ciągu pół roku (Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial – PubMed) (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed). Dzięki temu agoniści GLP-1 są szczególnie zalecani u chorych z cukrzycą i jednocześnie nadwagą lub otyłością – wytyczne podkreślają ich przewagę nad lekami powodującymi przyrost masy ciała (Systematic review of the efficacy and safety of GLP-1 receptor agonists in the treatment of patients with type 2 diabetes mellitus).
Co ważne, obniżenie glikemii osiągane jest bez istotnego ryzyka hipoglikemii (w monoterapii lub w skojarzeniu z metforminą, inhibitorami SGLT2 czy tiazolidinedionami). Wynika to z mechanizmu zależnego od glukozy – insulina jest stymulowana tylko w hiperglikemii. W badaniach klinicznych częstość ciężkiej hipoglikemii przy stosowaniu agonistów GLP-1 była zbliżona do placebo (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Należy jednak pamiętać, że w skojarzeniu z insuliną lub pochodnymi sulfonylomocznika epizody hipoglikemii mogą się pojawić – stąd rekomenduje się redukcję dawek tych leków przy włączaniu analogu GLP-1 (np. zmniejszenie dawki insuliny o ~20–30% lub odstawienie sulfonylomocznika) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf).
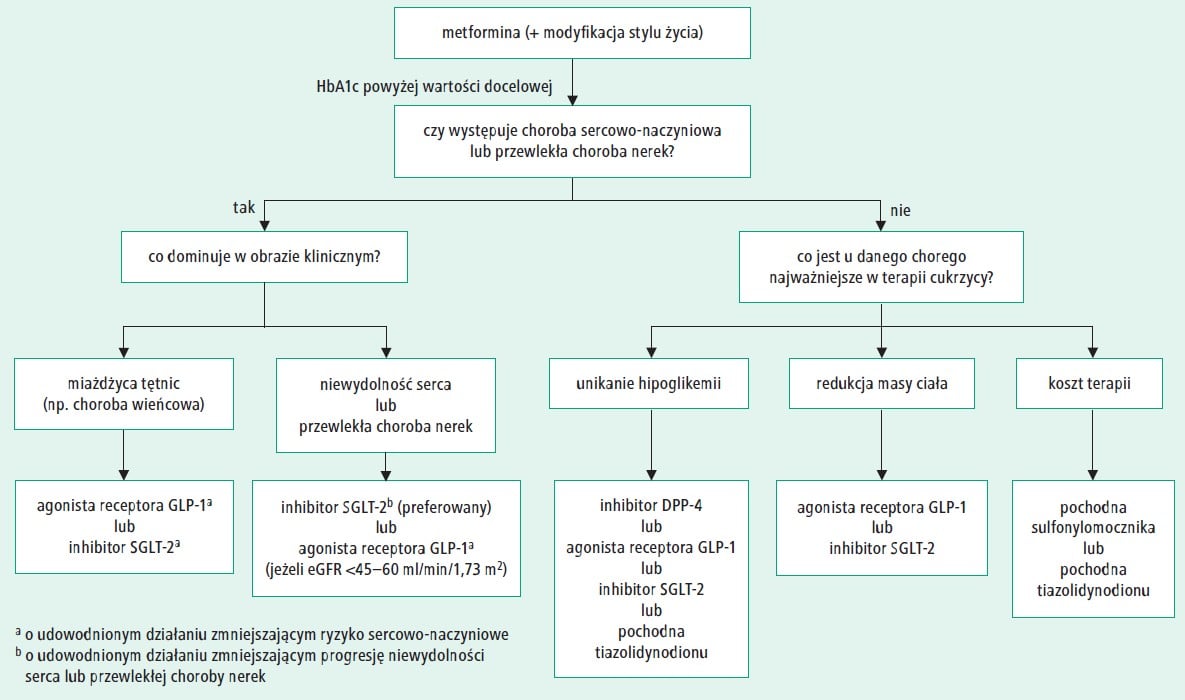
Redukcja ryzyka sercowo-naczyniowego: Przełomowym odkryciem ostatnich lat było wykazanie, że niektóre agoniści GLP-1 chronią przed incydentami sercowo-naczyniowymi u pacjentów z cukrzycą typu 2. W wielkich randomizowanych badaniach klinicznych z lat 2015–2019 stwierdzono istotne zmniejszenie ryzyka wystąpienia tzw. MACE (ang. major adverse cardiovascular events – zawał serca, udar, zgon sercowo-naczyniowy) w porównaniu z placebo. Przykładowo, w badaniu LEADER (9340 pacjentów, mediana obserwacji 3,8 roku) liraglutyd zredukował ryzyko pierwszego incydentu sercowo-naczyniowego o 13% względem placebo (HR 0,87; p=0,01 dla wyższości) (Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes – PubMed). Jednocześnie odnotowano mniejsze ryzyko zgonu z przyczyn sercowo-naczyniowych (HR 0,78; 95% CI 0,66–0,93) oraz ogólnej śmiertelności (HR 0,85; p=0,02) przy terapii liraglutydem (Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes – PubMed) (Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes – PubMed). Podobne wyniki uzyskano dla analogów długo działających: w badaniu SUSTAIN-6 semaglutyd raz w tygodniu istotnie zmniejszył częstość udarów mózgu, a w badaniu REWIND dulaglutyd 1,5 mg spowodował znamienne obniżenie częstości MACE w porównaniu z placebo (11,9% vs 13,4%; HR 0,88; p=0,026) (Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial – PubMed). Co istotne, korzyści te obserwowano nie tylko u chorych z przebytymi incydentami, ale także w prewencji pierwotnej – np. w REWIND ~68% uczestników nie miało wcześniej zdiagnozowanej choroby sercowo-naczyniowej, a efekt był widoczny również w tej grupie (Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial – PubMed). Wyniki te ugruntowały pozycję agonistów GLP-1 jako leków o udowodnionym działaniu kardioprotekcyjnym. Aktualne wytyczne (np. ADA 2023) zalecają ich stosowanie u pacjentów z cukrzycą typu 2 i współistniejącą chorobą sercowo-naczyniową lub wysokim ryzykiem sercowym, w celu redukcji tego ryzyka (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf).
Terapia otyłości: Wysoka skuteczność agonistów GLP-1 w wywoływaniu utraty masy ciała zaowocowała ich zastosowaniem u osób z otyłością (bez cukrzycy). Liraglutyd w wysokiej dawce 3,0 mg został zatwierdzony w 2014 r. do leczenia otyłości pod nazwą Saxenda (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). W badaniu SCALE (56 tygodni, BMI ≥30 lub ≥27 z powikłaniami) liraglutyd 3,0 mg spowodował redukcję masy ciała o ok. 8% w porównaniu do ~2,6% w grupie placebo, a u 1/3 pacjentów uzyskano ≥10% utraty wagi (Once-Weekly Semaglutide in Adults with Overweight or Obesity – PubMed). Jeszcze silniejsze efekty przyniósł semaglutyd – analog o długim półtrwaniu, podawany raz na tydzień. W badaniu STEP-1 (68 tygodni, 1961 osób z otyłością, bez cukrzycy) semaglutyd w dawce 2,4 mg tygodniowo obniżył masę ciała średnio o –14,9%, podczas gdy w grupie placebo obserwowano –2,4% (różnica –12,4 pp) (Once-Weekly Semaglutide in Adults with Overweight or Obesity – PubMed). Ponad połowa uczestników na semaglutydzie schudła ≥15% masy ciała początkowej (vs zaledwie 5% na placebo) (Once-Weekly Semaglutide in Adults with Overweight or Obesity – PubMed). Tak znacząca utrata wagi (rzadko spotykana w farmakoterapii otyłości przed erą inkretyn) przekłada się na poprawę parametrów metabolicznych – w STEP-1 odnotowano wyraźną poprawę ciśnienia tętniczego, profilu lipidowego oraz jakości życia chorych (Once-Weekly Semaglutide in Adults with Overweight or Obesity – PubMed). W konsekwencji semaglutyd 2,4 mg został zarejestrowany jako lek na otyłość (preparat Wegovy). Podawany jest raz w tygodniu i wraz z interwencją stylu życia stanowi obecnie jedną z najskuteczniejszych dostępnych metod leczenia otyłości.
Wpływ na powikłania otyłości: Utrata masy ciała wywołana agonistami GLP-1 przekłada się na redukcję ryzyka metabolicznych i sercowo-naczyniowych konsekwencji otyłości. W badaniach u osób bez cukrzycy obserwowano poprawę tolerancji glukozy, często wręcz remisję stanu przedcukrzycowego. Ponadto leczenie semaglutydem wiązało się z obniżeniem stężenia CRP i markerów stłuszczenia wątroby, spadkiem ciśnienia krwi o ~5 mmHg oraz poprawą funkcji oddechowej i wydolności wysiłkowej u pacjentów z dusznością wysiłkową i obturacją (np. w obturacyjnym bezdechu sennym) (Once-Weekly Semaglutide in Adults with Overweight or Obesity – PubMed). Najnowsze dane (omówione w rozdz. 8) sugerują, że redukcja masy ciała pod wpływem agonistów GLP-1 może także zmniejszać ryzyko incydentów sercowo-naczyniowych nawet u osób bez cukrzycy, co ma ogromne znaczenie w prewencji chorób serca.
- Semaglutyd vs liraglutyd vs dulaglutyd – skuteczność i farmakokinetyka
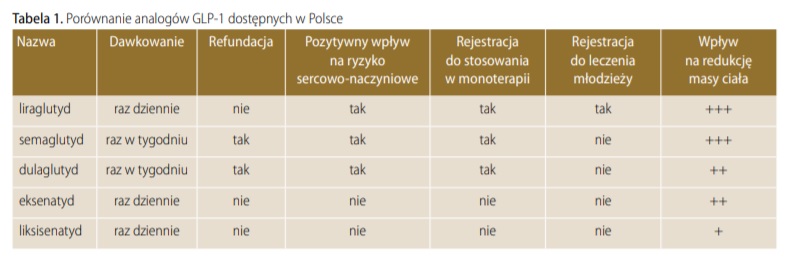
Główne cząsteczki i profil farmakokinetyczny: Liraglutyd, dulaglutyd i semaglutyd to trzy najczęściej stosowane obecnie agonisty GLP-1. Różnią się budową, czasem działania oraz sposobem podawania. Liraglutyd jest analogiem ludzkiego GLP-1 (homologia 97%) o średnim czasie półtrwania ~13 godzin – wymaga codziennych wstrzyknięć podskórnych (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC). Dulaglutyd to z kolei zmodyfikowany analog GLP-1 połączony z fragmentem przeciwciała, co zwiększa jego masę cząsteczkową i chroni przed szybką eliminacją; ma on okres półtrwania ok. 5 dni i podawany jest raz na tydzień (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC). Semaglutyd (homologia 94%) również charakteryzuje się wydłużonym działaniem – T1/2 wynosi ok. 7 dni, co pozwala na dawkowanie raz w tygodniu podskórnie (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC). Dodatkowo semaglutyd jest dostępny jako jedyny w formie doustnej (tabletki, produkt Rybelsus), dzięki specjalnej technologii ułatwiającej wchłanianie – wówczas przyjmuje się go codziennie na czczo.
Tak długi czas działania dulaglutydu i semaglutydu przynosi korzyści w postaci rzadszych iniekcji, co może poprawiać wygodę i adherencję pacjentów. Dane z rejestrów wskazują, że w warunkach real-world pacjenci leczeni analogami raz w tygodniu rzadziej przerywają terapię niż przy lekach wymagających codziennych zastrzyków (Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States – PubMed). W jednym z badań obserwacyjnych w USA odsetek chorych trwających w terapii po 12 miesiącach wyniósł 55% dla dulaglutydu vs 44% dla liraglutydu (p<0,001) (Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States – PubMed). Również odsetek osób regularnie przyjmujących lek (adherencja PDC ≥80%) był istotnie wyższy dla dulaglutydu (51% vs 38%) (Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States – PubMed). Wynika to zarówno z wygody (jedno wstrzyknięcie na tydzień zamiast siedmiu), jak i z mniejszej uciążliwości objawów ubocznych przy wolniejszym narastaniu stężenia leku (dzięki dłuższemu T1/2).
Porównanie skuteczności glikemicznej: Bezpośrednie badania porównawcze (head-to-head) wykazały pewne różnice w sile działania poszczególnych agonistów GLP-1. Semaglutyd generalnie osiąga największą redukcję HbA1c i masy ciała, przewyższając liraglutyd i dulaglutyd w podobnych dawkach. W próbie SUSTAIN-7 (1201 pacjentów z T2D) semaglutyd 1,0 mg raz w tygodniu obniżył HbA1c o 1,8% w 40 tygodniach, podczas gdy dulaglutyd 1,5 mg – o 1,4% (różnica ~0,4 pp na korzyść semaglutydu; p<0,0001) (Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial – PubMed). Jednocześnie spadek masy ciała wyniósł ~6,5 kg na semaglutydzie vs ~3,0 kg na dulaglutydzie (różnica ~3,5 kg; p<0,0001) (Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial – PubMed). W badaniu SUSTAIN-10 porównano semaglutyd 1,0 mg raz w tygodniu z liraglutydem 1,2 mg raz dziennie – również tu wyniki faworyzowały semaglutyd: HbA1c obniżyło się o 1,7% vs 1,0% (różnica 0,69%, p<0,0001), a masa ciała o 5,8 kg vs 1,9 kg (różnica ~3,8 kg) (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed). Istotnie więcej chorych osiągnęło cel HbA1c<7% i utratę ≥5% masy ciała w grupie semaglutydu (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed). Obie terapie były dobrze tolerowane, choć semaglutyd częściej powodował przemijające dolegliwości żołądkowo-jelitowe (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed).
Dulaglutyd i liraglutyd były również bezpośrednio porównane (np. badanie AWARD-6): dulaglutyd 1,5 mg okazał się nie gorszy od liraglutydu 1,8 mg pod względem obniżenia glikemii (HbA1c spadek ~1,4% w obu grupach), przy podobnej utracie masy (ok. 2,5–3 kg) i zbliżonym profilu działań niepożądanych (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC) (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC). W praktyce klinicznej wybór często zależy od preferencji pacjenta co do częstotliwości dawkowania oraz od indywidualnej tolerancji. Niemniej pojawienie się semaglutydu – jako najsilniejszego analogu – zmieniło standardy terapii i obecnie stanowi on częsty wybór, zwłaszcza u osób wymagających intensywnej kontroli glikemii i istotnej redukcji masy ciała.
Wpływ na adherencję i satysfakcję pacjenta: Rzadsze podawanie (raz na tydzień) to duża wygoda dla chorego. Badania ankietowe wykazały, że pacjenci preferują terapię raz w tygodniu niż raz na dzień, co przekłada się na lepszą satysfakcję z leczenia (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC). Wspomniane dane real-world (Mody et al. 2019) potwierdziły wyższą adherencję do dulaglutydu vs liraglutydu – po 12 miesiącach terapii ~55% chorych wciąż stosowało dulaglutyd, podczas gdy przy liraglutydzie często następowało przerwanie leczenia (tylko 44% pozostało na terapii) (Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States – PubMed). Co interesujące, w tej analizie dulaglutyd dał też nieco większą poprawę HbA1c niż liraglutyd w warunkach rzeczywistych (średnia redukcja –0,34% vs –0,32%, p=0,032) (Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States – PubMed), co może wynikać właśnie z lepszej konsekwencji w stosowaniu leku przez pacjentów. Z praktycznego punktu widzenia, semaglutyd łączy zaletę wysokiej skuteczności z dogodnym dawkowaniem tygodniowym – stąd zdobył on dominującą pozycję w wielu krajach jako preferowany agonista GLP-1.
- Bezpieczeństwo terapii: działania niepożądane i monitorowanie
Działania niepożądane ze strony przewodu pokarmowego: Najczęstsze skutki uboczne agonistów GLP-1 dotyczą układu pokarmowego. Należą do nich przede wszystkim nudności, wymioty, biegunka oraz czasem zaparcia czy niestrawność (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Nudności występują u kilkunastu do kilkudziesięciu procent chorych (często zależnie od dawki i preparatu – np. w badaniu STEP-1 na semaglutydzie 2,4 mg częstość wyniosła ~42% vs 11% w placebo) (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed). Objawy te zwykle mają charakter łagodny do umiarkowanego i pojawiają się głównie w fazie zwiększania dawki. Mechanizm wiąże się z opóźnianiem opróżniania żołądka i działaniem centralnym na ośrodek sytości – paradoksalnie są to efekty pożądane dla skuteczności, ale prowadzące do dyskomfortu. Strategie minimalizacji ryzyka: Zaleca się powolną titrację dawki (np. rozpoczęcie od najmniejszej dawki startowej i zwiększanie co 4 tygodnie), co pozwala organizmowi przyzwyczaić się i zmniejsza nasilenie nudności (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Pomocne jest także edukowanie pacjenta, by przerwał jedzenie w momencie poczucia sytości – przejedzenie się na leku inkretynowym często wyzwala wymioty. Dolegliwości żołądkowo-jelitowe zwykle ustępują z czasem trwania terapii i rzadko prowadzą do przerwania leczenia (odsetek trwałych wycofań z powodu działań niepożądanych GI wynosi ~5–10%) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). W razie nasilonych wymiotów warto monitorować parametry nerkowe, gdyż odwodnienie spowodowane utratą płynów może przejściowo pogarszać funkcję nerek (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf).
Ryzyko hipoglikemii: Monoterapia agonistami GLP-1 praktycznie nie powoduje ciężkich hipoglikemii. W badaniach rejestrowych nie odnotowano epizodów ciężkiej hipoglikemii wywołanej bezpośrednio tymi lekami (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Jednak w skojarzeniu z insuliną lub sekretagogami (pochodne sulfonylomocznika, glinidy) ryzyko hipoglikemii wzrasta ze względu na działanie tych drugich. Zalecenia: Gdy planuje się dołączenie agonisty GLP-1 do insulinoterapii lub pochodnej sulfonylomocznika, należy rozważyć redukcję dawki insuliny (np. o ~20%) i/lub odstawienie lub zmniejszenie dawki sulfonylomocznika (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Pacjentów należy poinformować o objawach niedocukrzenia i potrzebie modyfikacji terapii glikemizującej w razie ich wystąpienia.
Zapalenie trzustki: Kwestia bezpieczeństwa trzustki przy długotrwałej stymulacji inkretynowej była intensywnie badana. W latach poprzednich pojawiały się doniesienia o możliwym związku analogów GLP-1 z ostrym zapaleniem trzustki, jednak obecnie brak jednoznacznych dowodów na zwiększenie częstości OZT u ludzi (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Wręcz przeciwnie, w badaniach kardioprotekcyjnych częstość zapalenia trzustki w grupach leczonych agonistami GLP-1 nie przewyższała grup placebo – np. w LEADER incydenty OZT były nieco rzadsze wśród otrzymujących liraglutyd niż na placebo (nieistotnie statystycznie) (Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes – PubMed). Mimo to regulatorzy zalecają zachować ostrożność: agoniści GLP-1 są przeciwwskazani u osób z przebytym zapaleniem trzustki, a w razie wystąpienia objawów sugerujących OZT (silny ból brzucha z wysoką amylozą/lipazą) lek należy odstawić (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Lekarze powinni poinformować pacjenta o tym rzadkim ryzyku i pouczyć, by zgłaszał ewentualne ostre dolegliwości brzuszne. W praktyce jednak częstość OZT jest bardzo niska (około 3 przypadki na 1000 pacjentolat w grupach badanych vs 4/1000 w kontrolnych, różnice nieistotne) (Pancreatitis Risk Associated with GLP-1 Receptor Agonists …).
Kancerogeneza tarczycy: W badaniach na gryzoniach wysokie dawki analogów GLP-1 powodowały rozrost komórek C tarczycy i rozwój guzów (raków rdzeniastych). Mechanizm u ludzi jest niepewny – receptory GLP-1 wykryto w tarczycy zwierząt, ale u człowieka ekspresja na komórkach C jest minimalna. Niemniej wszystkie analogi GLP-1 mają ostrzeżenie o potencjalnym ryzyku raka rdzeniastego tarczycy (MTC) na podstawie danych zwierzęcych. W dotychczasowych badaniach klinicznych nie zaobserwowano zwiększenia częstości MTC ani wzrostu kalcytoniny we krwi (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Jednak z ostrożności przeciwwskazane jest ich stosowanie u osób z zespołem MEN2 lub rodzinnie występującym rakiem rdzeniastym tarczycy (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Nie ma natomiast dowodów na zwiększenie ryzyka innych nowotworów – obserwacja pacjentów leczonych >5 lat nie wykazała różnicy w częstości nowotworów ogółem vs placebo (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed). Monitoring kalcytoniny rutynowo nie jest zalecany (tylko w razie podejrzeń klinicznych guzka tarczycy).
Inne działania niepożądane: U niektórych chorych notuje się przyspieszenie tętna o ok. 2–4 ud/min (mechanizm kompensacyjny przy spadku masy ciała i działaniu w OUN). W rzadkich przypadkach może wystąpić reakcja alergiczna – szczególnie na egzendynowe analogi (eksenatyd), które mogą indukować przeciwciała. Dulaglutyd i semaglutyd jako leki peptydowe o dużym powinowactwie rzadko wywołują immunogenność; jeśli już, mogą pojawić się przeciwciała neutralizujące (najczęściej przy eksenatydzie), co osłabia efekt leku (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). U <0,5% pacjentów odnotowano reakcje anafilaktyczne lub obrzęk naczynioruchowy – wówczas terapia jest przeciwwskazana w przyszłości. Ponadto zaobserwowano nieznacznie zwiększone ryzyko kamicy żółciowej podczas długotrwałego leczenia agonistami GLP-1 (wzrost względny ~30–60%) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Wiąże się to prawdopodobnie ze szybkim chudnięciem i zmianami w motoryce pęcherzyka. W razie objawów kolki żółciowej zaleca się diagnostykę w kierunku kamicy.
Monitorowanie pacjentów: W trakcie terapii agonistą GLP-1 należy okresowo oceniać:
- Stan nawodnienia i czynność nerek, zwłaszcza u osób starszych lub w razie przedłużających się wymiotów/biegunek (ryzyko ostrego uszkodzenia nerek z odwodnienia) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf).
- Profil glikemii (pod kątem ewentualnej modyfikacji innych leków przeciwcukrzycowych, by uniknąć hipoglikemii).
- Tolerancję pokarmową – kontrolować masę ciała, apetyt i nasilenie nudności; dostosować tempo zwiększania dawki do tolerancji.
- Objawy zapalenia trzustki – informować pacjenta, by zgłaszał silne bóle brzucha, i w razie ich wystąpienia oznaczyć amylazę/lipazę.
- Czynność tarczycy – rutynowo nie ma zaleceń oznaczania kalcytoniny, ale należy zbadać tarczycę palpacyjnie przy wizytach kontrolnych; ewentualne objawy (dysfagia, chrypka, guz) są wskazaniem do USG tarczycy, choć to skrajnie rzadkie przypadki.
Podsumowując, agoniści GLP-1 cechują się dobrym profilem bezpieczeństwa. Najważniejsze jest właściwe prowadzenie pacjenta w początkowym okresie (wolna titracja, edukacja dot. diety) oraz uwzględnienie przeciwwskazań (stan po OZT, MEN2, ciąża – leków tych nie stosuje się w ciąży ani w okresie karmienia). Wieloletnie badania trwają – konieczne jest dalsze monitorowanie, czy nie pojawią się bardzo rzadkie działania (np. wpływ na tarczycę czy trzustkę) w długim (>10 lat) horyzoncie czasowym (Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists: Exploring Their Impact on Diabetes, Obesity, and Cardiovascular Health Through a Comprehensive Literature Review – PMC) (Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists: Exploring Their Impact on Diabetes, Obesity, and Cardiovascular Health Through a Comprehensive Literature Review – PMC).
- Nowatorskie zastosowania agonistów GLP-1
Oprócz cukrzycy typu 2 i otyłości, trwają intensywne badania nad wykorzystaniem agonistów GLP-1 w innych schorzeniach. Szczególne zainteresowanie budzą choroby metaboliczne wątroby oraz choroby neurodegeneracyjne, gdzie wyniki przedkliniczne były obiecujące.
Niealkoholowa stłuszczeniowa choroba wątroby (NAFLD/NASH): Otyłość i cukrzyca sprzyjają stłuszczeniu wątroby, które u części pacjentów postępuje do niealkoholowego stłuszczeniowego zapalenia wątroby (NASH) i zwłóknienia. Ponieważ agoniści GLP-1 indukują znaczny spadek masy ciała i poprawę insulinooporności, zaczęto badać ich wpływ na NASH. W 2021 r. opublikowano wyniki 72-tygodniowego badania fazy II z semaglutydem u chorych z NASH potwierdzoną biopsyjnie (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed). Semaglutyd podskórny (w dawkach 0,1–0,4 mg codziennie) istotnie częściej powodował ustąpienie zapalenia wątroby (NASH) w porównaniu z placebo: przy najwyższej dawce 0,4 mg u 59% pacjentów uzyskano remisję NASH, podczas gdy w grupie placebo jedynie u 17% (p<0,001) (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed). Tak spektakularna poprawa histologiczna (zanik zmian zapalnych i ballooningu hepatocytów) nie przełożyła się jednak na znaczącą poprawę włóknienia – odsetek chorych z redukcją stadium włóknienia nie różnił się istotnie statystycznie od placebo (43% vs 33%) (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed). Niemniej tak duża skuteczność w eliminacji NASH była przełomem w tej trudnej do leczenia chorobie. Warto podkreślić, że pacjenci ci stracili średnio ~13% masy ciała pod wpływem semaglutydu (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed), co zapewne było głównym czynnikiem regresji stłuszczeniowego zapalenia. Obecnie trwa badanie fazy III z semaglutydem 2,4 mg tygodniowo u pacjentów z NASH, aby ocenić wpływ na twarde punkty końcowe (zwłóknienie, marskość). Również liraglutyd wykazał korzystny wpływ w mniejszym 48-tygodniowym badaniu – więcej pacjentów na liraglutydzie miało poprawę histologii wątroby niż na placebo (Liraglutide Trial Was Negative Four Years Ago, Still Negative Today). W sumie, agoniści GLP-1 (zwłaszcza semaglutyd) jawią się jako obiecująca terapia NASH, zwłaszcza u chorych z współistniejącą otyłością i cukrzycą. W najbliższych latach możliwe, że semaglutyd uzyska formalne wskazanie w leczeniu NASH, jeśli badania III fazy potwierdzą jego skuteczność.
Choroby neurodegeneracyjne (np. choroba Alzheimera, Parkinsona): Receptory GLP-1 obecne są w mózgu, a badania na modelach zwierzęcych sugerowały efekty neuroprotekcyjne – m.in. zmniejszenie odkładania beta-amyloidu, hamowanie stresu oksydacyjnego i procesów zapalnych w mózgu (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects) (Frontiers | GLP-1 Receptor Agonists: Beyond Their Pancreatic Effects). To skłoniło naukowców do przetestowania agonistów GLP-1 w chorobie Alzheimera (AD) i Parkinsona (PD).
W chorobie Alzheimera największe jak dotąd badanie kliniczne to trial fazy IIb ELAD (Evaluate Liraglutide in Alzheimer’s Disease), w którym przez 12 miesięcy podawano liraglutyd 1,8 mg dziennie pacjentom z wczesną AD. Niestety, wyniki nie spełniły oczekiwań – nie osiągnięto istotnej poprawy w pierwotnym punkcie końcowym (zmiana metabolizmu glukozy w mózgu w FDG-PET) (Liraglutide Trial Was Negative Four Years Ago, Still Negative Today | ALZFORUM). Również drugorzędowe punkty, jak tempo spadku funkcji poznawczych i objętości hipokampa w MRI, nie różniły się znacząco między grupami (Liraglutide Trial Was Negative Four Years Ago, Still Negative Today | ALZFORUM). Doniesienia medialne w 2023 r. sugerowały pewne pozytywne sygnały (np. wolniejszy zanik mózgu u podgrupy chorych), ale ogólny wydźwięk badania był negatywny. Liraglutyd okazał się bezpieczny u tych pacjentów, lecz nie zahamował postępu choroby. Mimo tego, trwają dalsze próby – m.in. bada się semaglutyd w fazie III (studium EVOKE u osób z wczesną AD). Semaglutyd, silniejszy i przenikający do OUN, ma teoretycznie większy potencjał. Wyniki spodziewane są w najbliższych latach. Z kolei w chorobie Parkinsona najwięcej uwagi przyciągnął eksenatyd (agonista GLP-1 pochodzenia gadziego). W pilotażowym badaniu fazy II (Lancet 2017) eksenatyd (Bydureon, 2 mg/tydz.) wykazał poprawę kliniczną – pacjenci mieli lepsze wyniki skali UPDRS niż grupa placebo po 48 tygodniach, co zasugerowało możliwe spowolnienie choroby. Jednak niedawno zakończone duże badanie fazy III (trial EXENATIDE-PD3, 2022–2023) nie potwierdziło skuteczności – eksenatyd wprawdzie był bezpieczny i dobrze tolerowany, ale nie spowolnił postępu Parkinsona w porównaniu z placebo (Exenatide once a week versus placebo as a potential disease-modifying treatment for people with Parkinson’s disease in the UK: a phase 3, multicentre, double-blind, parallel-group, randomised, placebo-controlled trial – PubMed). Nie stwierdzono różnic w pogorszeniu objawów motorycznych ani w markerach obrazowych neurodegeneracji (Exenatide once a week versus placebo as a potential disease …). Mimo rozczarowania, badacze wskazują, że być może inne cząsteczki o lepszej penetracji do mózgu lub terapia wcześniejsza w przebiegu choroby mogłyby dać odmienne rezultaty (Exenatide once a week versus placebo as a potential disease-modifying treatment for people with Parkinson’s disease in the UK: a phase 3, multicentre, double-blind, parallel-group, randomised, placebo-controlled trial – PubMed). Na horyzoncie są także analogi dualne i triple (np. tirzepatid, retatrutyd – patrz rozdz. 7), które potencjalnie mogą mieć silniejsze działanie neuroprotekcyjne dzięki szerszemu spectrum (GLP-1 + GIP + glukagon). Podsumowując, dane kliniczne w neurodegeneracjach na razie nie są przełomowe – liraglutyd w AD i eksenatyd w PD nie przyniosły istotnych korzyści klinicznych. Niemniej obserwacje te nie przekreślają koncepcji inkretyn w chorobach OUN – trwają kolejne próby (m.in. semaglutyd w AD), a laboratoria intensywnie badają mechanizmy, by zidentyfikować grupy chorych mogących odnieść ewentualną korzyść (Exenatide once a week versus placebo as a potential disease-modifying treatment for people with Parkinson’s disease in the UK: a phase 3, multicentre, double-blind, parallel-group, randomised, placebo-controlled trial – PubMed).
Inne nowe wskazania: Pojawiają się doniesienia o potencjalnej użyteczności agonistów GLP-1 w:
- Chorobach serca niezwiązanych z cukrzycą: np. niewydolność serca z zachowaną frakcją wyrzutową (HFpEF) – o czym więcej w rozdz. 8,
- Zaburzeniach odżywiania: trwają badania nad wykorzystaniem analogów GLP-1 w kompulsyjnym objadaniu się czy uzależnieniach (ze względu na wpływ na ośrodek nagrody i apetyt),
- PCOS (zespół policystycznych jajników): pilotażowe badania sugerują, że dodanie liraglutydu do leczenia PCOS u otyłych pacjentek poprawia metabolizm i może sprzyjać owulacji dzięki spadkowi masy ciała (Liraglutide Reduces Vascular Damage, Neuronal Loss, and …),
- Cukrzyca typu 1: testuje się czy agoniści GLP-1 mogą pomóc w wyrównaniu metabolicznym i redukcji wagi u chorych z DM1 z nadwagą (bez wpływu na sam niedobór insuliny, ale pomocniczo).
Na obecnym etapie kluczowe i najbardziej „wiarygodne” dane kliniczne dotyczą jednak NASH (faza II z semaglutydem) i są podstawą do optymizmu, że agoniści GLP-1 znajdą zastosowanie poza cukrzycą i otyłością.
- Ograniczenia obecnych badań i terapii
Mimo imponujących sukcesów tej klasy leków, istnieje szereg ograniczeń i wyzwań związanych z długoterminowym stosowaniem agonistów GLP-1 oraz z bazą dowodową:
Brak długoterminowych danych (>10 lat): Najdłuższe dotąd obserwacje z randomizowanych badań trwają około 5–6 lat (np. programy LEADER, REWIND). Brakuje danych z dekady czy dwóch dekad terapii. Nie wiemy więc na pewno, czy wieloletnia stymulacja receptorów GLP-1 nie niesie bardzo późnych skutków ubocznych. Teoretycznie, obawy budzi trzustka i tarczyca – np. czy po >10 latach nie wzrośnie jednak częstość przewlekłych zapaleń trzustki lub drobnych zmian nowotworowych w tarczycy bądź trzustce (czego dotąd nie wykryto) (Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists: Exploring Their Impact on Diabetes, Obesity, and Cardiovascular Health Through a Comprehensive Literature Review – PMC) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Konieczne jest kontynuowanie rejestrów i obserwacji, by wychwycić ewentualne ultra-rzadkie zdarzenia. Również wpływ na retinopatię cukrzycową wymaga uwagi – w badaniu SUSTAIN-6 odnotowano paradoksalnie więcej powikłań retinopatii w grupie semaglutydu, co tłumaczono nagłą poprawą glikemii (efekt podobny do intensywnej insulinoterapii). W kolejnych latach trzeba będzie ocenić, czy intensywne odchudzanie i poprawa metaboliczna poprzez GLP-1 nie wpływa np. na nasilenie niektórych powikłań cukrzycy u podatnych osób (choć dotychczasowe analizy nie potwierdziły utrzymującego się wzrostu ryzyka retinopatii).
Koszt i dostępność leczenia: Agoniści GLP-1 należą do drogich terapii. Szacunkowy koszt rocznej kuracji w krajach rozwiniętych sięga $5–10 tysięcy (USD) na pacjenta (Growth, Volume, Price: The Skinny on GLP-1 Medications). W Europie roczny koszt analogów inkretyn (~€5000–7000) jest wyższy niż np. inhibitorów SGLT2 (Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists). W wielu krajach dostępność refundacji jest ograniczona do wąskich wskazań (np. cukrzyca z określonym BMI lub powikłaniami sercowymi). Wysoki koszt stanowi poważną barierę – analizy wskazują, że pacjenci obarczeni problemami finansowymi częściej przerywają terapię przedwcześnie ([PDF] Real-world trends in GLP-1 treatment persistence and prescribing …). W badaniach real-world niemal połowa pacjentów rozpoczynających analog GLP-1 przerywa leczenie w ciągu pierwszego roku (GLP-1 RA Discontinuations Frequent in People with Obesity Without …), głównie z powodów ekonomicznych lub z powodu niedostatecznej tolerancji efektów ubocznych. Ponadto, gwałtowny wzrost popytu na semaglutyd/liraglutyd w leczeniu otyłości w latach 2021–2023 spowodował okresowe niedobory leków na rynku, co również utrudniało ciągłość terapii. Problem kosztów dotyczy też systemów opieki zdrowotnej – trwa dyskusja, jak zwiększyć opłacalność (cost-effectiveness) tych leków. Analizy farmakoekonomiczne sugerują, że u wybranych pacjentów (z wysokim ryzykiem sercowym) koszty mogą się zwrócić poprzez uniknięte zawały/udary (Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists: Exploring Their Impact on Diabetes, Obesity, and Cardiovascular Health Through a Comprehensive Literature Review – PMC) (Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists: Exploring Their Impact on Diabetes, Obesity, and Cardiovascular Health Through a Comprehensive Literature Review – PMC), ale u innych grup opłacalność jest wątpliwa. Rozważane są modele współpłacenia oparte na efektach klinicznych (value-based pricing) (Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists: Exploring Their Impact on Diabetes, Obesity, and Cardiovascular Health Through a Comprehensive Literature Review – PMC) – np. niższa cena, jeśli pacjent nie osiągnie pewnego progu utraty wagi.
Heterogeniczność populacji badanych: Większość dużych badań kardiometabolicznych z agonistami GLP-1 przeprowadzono w populacjach dorosłych w średnim/zaawansowanym wieku, często z przewagą rasy kaukaskiej i z określonym profilem ryzyka. Brakuje danych u pewnych podgrup:
- Młodsi pacjenci z cukrzycą typu 2: czy długotrwałe stosowanie od wczesnego okresu choroby przynosi korzyści i jest bezpieczne do późnej starości?
- Osoby ≥75–80 lat: seniorzy byli zwykle mniej reprezentowani w badaniach (np. w LEADER średni wiek ~64 lata) – czy w tej grupie korzyści (np. zapobieganie udarom) równoważą ryzyko (np. odwodnienia wskutek wymiotów)?
- Różne grupy etniczne: czy np. populacja azjatycka czy afrykańska reaguje podobnie? (Badania w Japonii, np. PIONEER 9/10, potwierdziły skuteczność semaglutydu w populacji japońskiej (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC) (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC), ale nadal globalnie większość danych pochodzi z populacji europejskiej/amerykańskiej).
- Dzieci i młodzież: Ostatnio semaglutyd zbadano u nastolatków z otyłością (12–18 lat), wykazując znaczną skuteczność w odchudzaniu podobną do dorosłych (Once-Weekly Semaglutide in Adolescents with Obesity). Jednak w cukrzycy typu 2 u dzieci dane są szczątkowe – dopiero niedawno zatwierdzono liraglutyd od 10 rż. (pojedyncze badania). Długofalowy wpływ na rosnący organizm nie jest pewny.
Profil działań ubocznych i akceptacja przez pacjentów: Choć działania niepożądane są generalnie znane i rzadko zagrażają życiu, to dolegliwości żołądkowo-jelitowe bywają uciążliwe. Część pacjentów odmawia kontynuacji leczenia z powodu przewlekłych nudności czy dyskomfortu związanego z jedzeniem. Ponadto codzienne wstrzykiwanie (w przypadku liraglutydu) lub nawet tygodniowe może stanowić barierę dla niektórych osób obawiających się igieł. Trwają prace nad postaciami doustnymi oraz lepszymi schematami zwiększania dawki, aby poprawić tolerancję – to jednak wciąż obszary do udoskonalenia.
Reasumując, największe ograniczenia to aspekt ekonomiczny oraz brak wiedzy o bardzo długoterminowych skutkach. Wyzwania te wymagają zarówno dalszych badań klinicznych, jak i działań systemowych (np. negocjacje cenowe, programy wsparcia pacjentów), aby w pełni wykorzystać potencjał agonistów GLP-1 w populacji.
- Kierunki rozwoju: doustne formy, terapie skojarzone i ultra-długie analogi
Rozwój terapii inkretynowych przebiega bardzo dynamicznie. W najbliższych latach spodziewane są nowe generacje leków, które mogą jeszcze bardziej rozszerzyć możliwości leczenia. Główne kierunki to:
Doustne formy agonistów GLP-1: Przełomem było wprowadzenie w 2019 r. pierwszego doustnego analogu GLP-1 – semaglutydu w tabletce (Rybelsus). Choć nadal wymaga on specjalnego podania (na czczo, popijając małą ilością wody, 30 minut przed posiłkiem) i biodostępność jest niska, to udowodnił skuteczność zbliżoną do formy iniekcyjnej (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC). Doustny semaglutyd (dawka 7–14 mg/d) obniża HbA1c o ~1,0–1,3% i masę ciała o 2–4 kg, będąc nie gorszy od liraglutydu 1,8 mg w badaniu PIONEER-4 (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC) (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed). Jego pojawienie się otworzyło drzwi do całkowicie nieinwazyjnej terapii inkretynowej. Obecnie trwają prace nad kolejnymi doustnymi związkami – szczególnie obiecujące są niepeptydowe agonisty GLP-1, które można podać doustnie bez degradacji w przewodzie pokarmowym. Przykładem jest orforglipron (LY3502970) – mała cząsteczka aktywująca receptor GLP-1. W 2023 r. opublikowano wyniki fazy II: doustny orforglipron podawany 1 × dziennie spowodował u osób z otyłością średnią utratę masy ciała nawet 14,7% po 36 tygodniach (Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity) (Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity), czyli porównywalną z semaglutydem 2,4 mg. U chorych z cukrzycą uzyskano zaś znaczące obniżenie HbA1c (o ~1,3–1,5%) i masy ciała (~5–8 kg) po 26 tygodniach (Efficacy and safety of oral orforglipron in patients with type 2 diabetes). Jeśli kolejne fazy potwierdzą bezpieczeństwo, orforglipron może zostać pierwszym doustnym niepeptydowym agonistą GLP-1 dostępnym na rynku – co byłoby milowym krokiem, bo pozwoli uniknąć zastrzyków i potencjalnie obniży koszty produkcji. W badaniach znajdują się też inne doustne analogi (m.in. danuglipron od firmy Pfizer). Możliwe więc, że przyszłość leczenia będzie należeć do tabletek stymulujących GLP-1R, co znacznie zwiększy akceptację terapii przez pacjentów.
Agoniści podwójni i potrójni (terapie skojarzone hormonalnie): Sukces agonistów GLP-1 zainspirował naukowców do łączenia ich działania z innymi hormonami inkretynowymi. Szczególną furorę zrobił tirzepatyd – podwójny agonista receptora GLP-1 i glukozozależnego peptydu insulinotropowego (GIP). Tirzepatyd (znany jako Mounjaro) został zatwierdzony w 2022 r. do leczenia cukrzycy typu 2 po wykazaniu rewelacyjnych wyników w badaniach SURPASS. W porównaniu z semaglutydem 1 mg, tirzepatyd w najwyższych dawkach (10–15 mg raz w tygodniu) obniżał HbA1c silniej (–2,3% do –2,4% vs ~–1,9%) oraz powodował większą utratę masy ciała (–8 do –11 kg vs –6 kg na semaglutydzie) (Tirzepatide vs semaglutide: How do they compare? – Drugs.com) (The effectiveness and value of tirzepatide for type 2 diabetes mellitus). W jednym z badań 36% pacjentów na tirzepatydzie osiągnęło ≥15% spadku masy ciała, podczas gdy na semaglutydzie tylko 8% (The effectiveness and value of tirzepatide for type 2 diabetes mellitus). Tym samym tirzepatyd jest pierwszym lekiem, który przewyższył semaglutyd zarówno w kontroli glikemii, jak i odchudzaniu. Mechanizm wynika z dodatkowej stymulacji receptora GIP – co prawdopodobnie potęguje efekt insulinotropowy i wpływ na apetyt. Tirzepatyd jest już również badany w otyłości (program SURMOUNT) – w jednym z badań fazy III u osób z otyłością osiągnięto średnio 20% utraty masy ciała po 72 tygodniach (15 mg tygodniowo), a więc wynik dotąd niespotykany farmakologicznie. Spodziewana jest rejestracja tirzepatydu także jako leku na otyłość.
Kolejnym krokiem są agonisty potrójne – aktywujące jednocześnie GLP-1, GIP oraz receptor glukagonowy. Idea dodania komponenty glukagonowej wynika z chęci przyspieszenia metabolizmu (glukagon nasila spalanie kalorii i lipolizę). W 2023 r. opublikowano wyniki fazy II dla potrójnego agonisty retatrutyd: po 48 tygodniach dawki 12 mg tygodniowo uzyskano aż 24% spadku masy ciała u osób z otyłością (Triple–Hormone-Receptor Agonist Retatrutide for Obesity). To poziom zbliżający się do efektów operacji bariatrycznych! Retatrutyd poprawił też glikemię i inne parametry metaboliczne. Oczywiście, to wczesne wyniki i trzeba ocenić bezpieczeństwo (potrójna stymulacja może nasilać np. tachykardię czy ryzyko działań niepożądanych). Niemniej trend jest wyraźny – przyszłe leki mogą być kombinacją hormonów w jednej cząsteczce.
Warto wspomnieć, że obecnie nie zaleca się łączenia agonisty GLP-1 z inhibitorem DPP-4 (także wpływającym na inkretyny) – badania pokazały, że dodanie sitagliptyny/saksagliptyny do analogów GLP-1 nie poprawia kontroli, a może zwiększać ryzyko działań ubocznych (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Natomiast coraz częstsze jest skojarzenie agonisty GLP-1 z inhibitorem SGLT2 w terapii cukrzycy typu 2 – daje to komplementarne korzyści (silna kontrola glikemii, redukcja wagi przez GLP-1 i efekt natriuretyczny SGLT2, podwójna ochrona sercowo-nerkowa). Badania wykazały, że takie połączenie jest bardzo skuteczne i bezpieczne, i wytyczne rekomendują je u pacjentów z cukrzycą, otyłością i towarzyszącymi czynnikami ryzyka sercowo-naczyniowego.
Preparaty o ultra-długim czasie działania: Kolejnym celem jest wygoda pacjenta – trwają prace nad analogami wymagającymi jeszcze rzadszych iniekcji, np. co 2 tygodnie lub raz na miesiąc. Jednym z nich był efpeglenatyd (pochodna eksendyny opracowana przez Sanofi) – cechował się on bardzo długim półtrwaniem i testowano podawanie raz na 2–4 tygodnie. W badaniu fazy II efpeglenatyd podawany raz na miesiąc (po fazie wstępnej titracji tygodniowej) znacząco obniżył HbA1c vs placebo (różnica ~0,7% po 4 miesiącach) i redukował masę ciała o ~2 kg (Efficacy and safety of once-monthly efpeglenatide in patients with type 2 diabetes: Results of a phase 2 placebo-controlled, 16-week randomized dose-finding study – PubMed). Potwierdzono też względnie dobrą tolerancję – profil zdarzeń niepożądanych był podobny do innych analogów, choć nudności wystąpiły u ~30–50% pacjentów (w zależności od dawki) (Efficacy and safety of once‐monthly efpeglenatide in patients with …). Mimo obiecujących wyników, program efpeglenatydu został wstrzymany z powodów komercyjnych (Sanofi wycofało się z obszaru diabetologii). Inne firmy pracują jednak nad własnymi długo działającymi formułami. Ciekawą koncepcją jest np. implant podskórny eksenatydu (ITCA 650) – mały zbiorniczek wszczepiany pod skórę, uwalniający przez pół roku stałą dawkę leku. Testy wykazały skuteczność (poprawa HbA1c ~1% przy jednym implancie na 6 mies.), lecz problemy techniczne opóźniają dopuszczenie tego rozwiązania. Niemniej jest prawdopodobne, że raz w miesiącu lub rzadziej podawane agonisty GLP-1 pojawią się w przyszłości, co dalej ułatwi leczenie (np. pacjent mógłby otrzymywać zastrzyk depot raz na kwartał podczas wizyty).
Inne innowacje: Udoskonala się także formy podania – trwają prace nad sprayem donosowym z analogiem GLP-1, czy tabletkami podjęzykowymi, aby ominąć konieczność iniekcji. Pojawiają się też koncepcje terapii genowej: w modelach mysich dostarczano wektor z genem GLP-1 do wątroby, uzyskując długotrwałe uwalnianie GLP-1 do krwi. Choć to pieśń odległej przyszłości, pokazuje potencjał wykorzystania osi inkretynowej.
Podsumowując, przyszłość to jeszcze skuteczniejsze i łatwiejsze w użyciu leki inkretynowe: doustne, łączące działanie kilku hormonów i rzadziej podawane. Celem jest osiągnięcie maksymalnych korzyści metabolicznych (np. >20% spadku masy ciała, normalizacja glikemii) przy minimalnym obciążeniu dla pacjenta. Biorąc pod uwagę obecną dynamikę badań, najbliższe 5 lat przyniesie prawdopodobnie kolejne przełomowe terapie oparte o koncepcję agonistów GLP-1.
- Najnowsze doniesienia (2023–2025)
Ostatnie dwa lata przyniosły szereg przełomowych informacji na temat agonistów GLP-1, które dodatkowo rozszerzają ich zastosowania:
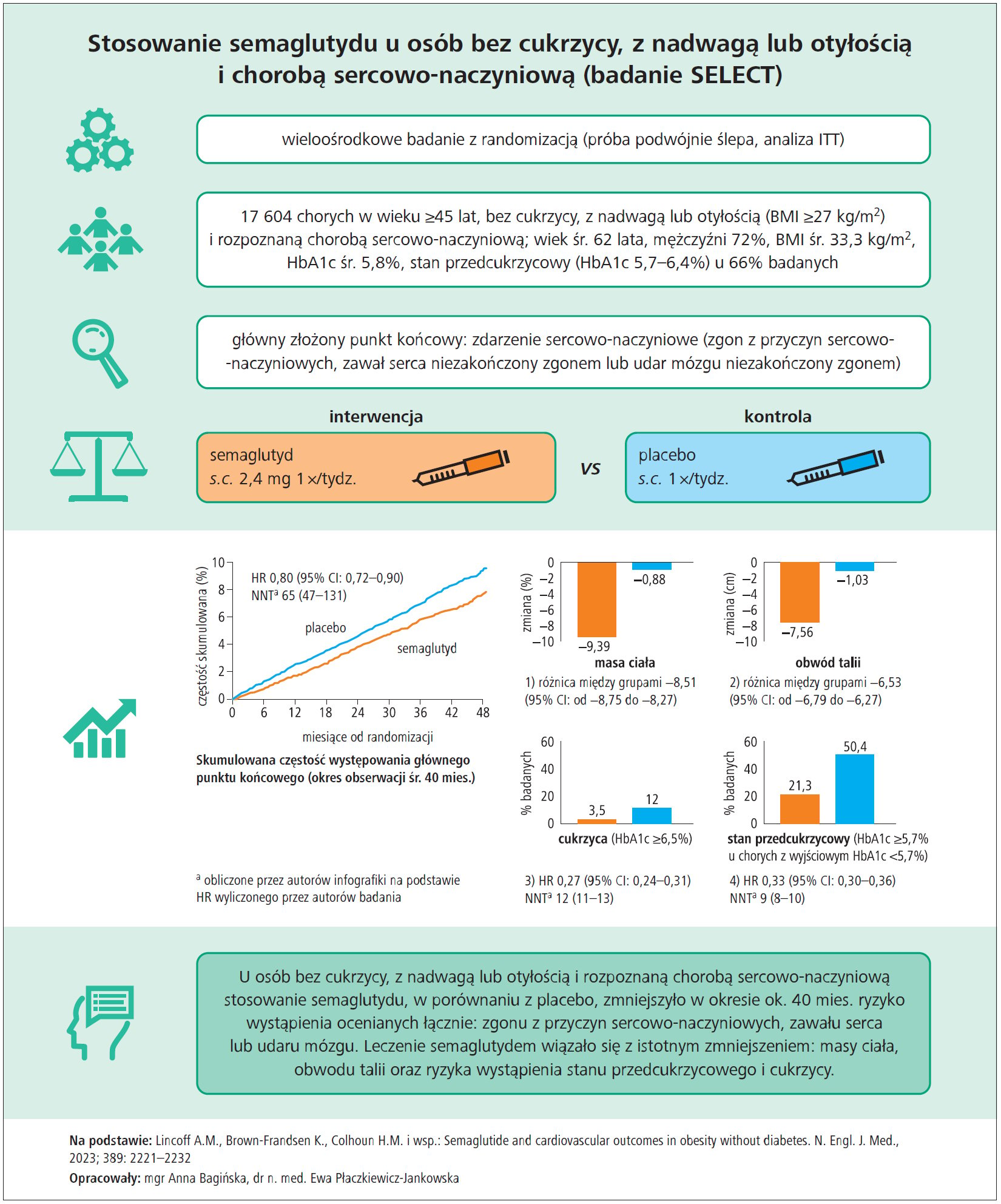
- Redukcja ryzyka sercowo-naczyniowego u osób z otyłością (bez cukrzycy): W 2023 r. ogłoszono wyniki monumentalnego badania SELECT (17 604 uczestników z otyłością, bez cukrzycy). Wykazano w nim, że semaglutyd 2,4 mg raz na tydzień istotnie zmniejsza częstość incydentów sercowo-naczyniowych (MACE) w porównaniu z placebo u pacjentów z nadwagą/otyłością i chorobą sercowo-naczyniową w wywiadzie (Long-term weight loss effects of semaglutide in obesity without …). Ryzyko 3-punktowego MACE spadło o 20% (HR ~0,80) przy średnim okresie obserwacji ~5 lat (Full SELECT Results Affirm CV Risk Reduction With Semaglutide in …) (Company announcement – News Details). To przełomowe odkrycie – po raz pierwszy wykazano, że „lek odchudzający” poprawia twarde punkty końcowe (zawał, udar, zgon) u osób bez cukrzycy. Wynik SELECT potwierdza, że otyłość jest modyfikowalnym czynnikiem ryzyka sercowego, a semaglutyd może pełnić rolę kardioprotekcyjną przez redukcję masy ciała. Prawdopodobnie doprowadzi to do zmiany standardów – leczenie otyłości stanie się elementem prewencji wtórnej chorób serca. Novo Nordisk zapowiedziało złożenie wniosku o rejestrację semaglutydu 2,4 mg właśnie w tym wskazaniu (prewencja incydentów przy otyłości). Publikacja szczegółowych wyników SELECT w NEJM (grudzień 2023) potwierdziła te obserwacje: MACE wystąpiło u 6,5% chorych na semaglutydzie vs 8,0% na placebo (HR 0,76; 95% CI 0,62–0,94) (Semaglutide and Cardiovascular Outcomes in Obesity without …) (Long-term weight loss effects of semaglutide in obesity without …). Co ważne, korzyść była widoczna już po ~1,5 roku terapii. SELECT to kamień milowy, który prawdopodobnie zwiększy jeszcze bardziej zainteresowanie farmakologicznym leczeniem otyłości w kontekście ochrony serca.
- Poprawa przebiegu niewydolności serca z zachowaną frakcją (HFpEF): W 2023 r. na kongresie ESC zaprezentowano wyniki badania STEP-HFpEF (semaglutyd 2,4 mg u pacjentów z HFpEF i otyłością). Wyniki jednocześnie opublikowano w NEJM (Semaglutide in Patients with Heart Failure with Preserved Ejection …). Semaglutyd przez 1 rok spowodował istotną poprawę zdolności wysiłkowej i jakości życia chorych z tym typem niewydolności serca – ocenianych kwestionariuszem KCCQ. Pacjenci na semaglutydzie mieli większą poprawę wyniku KCCQ (o +16 punktów vs +5 pkt w placebo; p<0,001) oraz dystansu w teście 6-minutowego marszu (Semaglutide in Patients with Heart Failure with Preserved Ejection …). Towarzyszyła temu znaczna utrata masy ciała (–13% vs –2%, zgodnie z oczekiwaniami). HFpEF to schorzenie, dla którego dotąd brakowało skutecznych terapii (poza ograniczoną skutecznością inhibitorów SGLT2). Wyniki STEP-HFpEF sugerują, że u pacjentów z niewydolnością serca i otyłością redukcja wagi semaglutydem przekłada się na ulgę w objawach i lepszą wydolność. W konsekwencji FDA zatwierdziła semaglutyd (Wegovy) w 2023 r. jako terapię wspomagającą u osób z otyłością i HFpEF. To kolejny przykład, jak leki inkretynowe znajdują zastosowanie poza klasyczną diabetologią, poprawiając parametry kliniczne trudnych schorzeń kardiologicznych (Semaglutide in Patients with Obesity-Related Heart Failure and …).
- Nowe wytyczne i rozszerzenia wskazań: W latach 2022–2023 wiele towarzystw naukowych zaktualizowało zalecenia, uwzględniając nowe dowody. Amerykańskie i europejskie wytyczne kardiologiczne zaczęły rekomendować rozważenie agonistów GLP-1 u pacjentów z otyłością i chorobą sercowo-naczyniową (na podstawie SELECT – choć formalnie czekano na publikację). ADA i EASD (2022/2023) jeszcze mocniej zaakcentowały priorytet użycia agonisty GLP-1 lub inhibitora SGLT2 jako leku pierwszego rzutu u chorych z cukrzycą typu 2 i współistniejącymi czynnikami ryzyka sercowo-naczyniowego lub przewlekłą chorobą nerek (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). W dziedzinie leczenia otyłości, pojawienie się semaglutydu i tirzepatydu skłoniło specjalistów do aktualizacji schematów postępowania – farmakoterapia jest teraz rekomendowana wcześniej i dla szerszej grupy pacjentów (BMI ≥30 lub ≥27 z powikłaniami).
- Terapie kombinowane i nowe leki: Jak wspomniano, tirzepatyd otrzymał w 2022 r. aprobatę FDA w cukrzycy typu 2. W 2023 r. zakończono badania SURMOUNT-2 u osób z cukrzycą i otyłością – tirzepatyd dał im średnio 15% redukcji masy ciała i poprawę wyrównania cukrzycy, potwierdzając wartość dodaną podwójnego agonisty. Oczekuje się wkrótce zatwierdzenia tirzepatydu również do leczenia otyłości. Równocześnie w badaniach pojawiły się agonisty potrójne. Retatrutyd (GLP-1/GIP/glukagon, firmy Lilly) w fazie II wykazał niespotykane dotąd ~24% obniżenie masy ciała w 48 tygodni, o czym donoszono na łamach NEJM w 2023 (Triple–Hormone-Receptor Agonist Retatrutide for Obesity). Choć to wciąż eksperymentalny lek, wyniki rozpaliły ogromne zainteresowanie – media okrzyknęły retatrutyd „potencjalnie najmocniejszym lekiem odchudzającym”. W perspektywie kilku lat spodziewane są dalsze dane i ewentualna rejestracja tych nowych klas. W Chinach dopuszczono w 2023 r. pemwolglytazę – pierwszy agonista GLP-1 przyjmowany raz na dwa tygodnie, co wskazuje na postęp w formulacjach long-acting.
- Badania nad bezpieczeństwem długoterminowym: Równolegle publikacje z 2023 r. uspokajają w kwestii niektórych wcześniejszych obaw. Na przykład duża analiza bazy FAERS (USA) wykazała, że częstość zgłoszeń ostrego zapalenia trzustki wśród użytkowników agonistów GLP-1 nie przewyższała innych terapii cukrzycy (a wręcz była minimalnie niższa) (Pancreatitis Risk Associated with GLP-1 Receptor Agonists …). W innym badaniu kohortowym nie stwierdzono zwiększenia ryzyka raka trzustki czy rdzeniastego tarczycy u leczonych inkretynami w obserwacji ~7-letniej (Association between different GLP-1 receptor agonists and acute …) (Glucagon-Like Peptide-1 Receptor Agonists – StatPearls – NCBI Bookshelf). Oczywiście są to obserwacje ograniczone czasowo, ale budujące.
- Inne nowe zastosowania: Pojawiły się ciekawe raporty użycia agonistów GLP-1 w niestandardowych sytuacjach. Wspomniane wykorzystanie semaglutydu w HFpEF to jedno. Inne to np. doniesienia o skuteczności liraglutydu w zmniejszaniu aktywności choroby u pacjentów z niealkoholowym stłuszczeniowym zapaleniem trzustki (poprawa profilu metabolicznego zmniejsza naciek tłuszczowy w trzustce i stan zapalny). Również w dziedzinie psychiatrii rozważa się inkretyny – badanie z 2023 r. sugeruje, że semaglutyd może redukować objawy zespołu kompulsywnego jedzenia i pomagać pacjentom z BED (binge-eating disorder) utracić na wadze i kontrolować napady (choć to niewielka próba, wymagająca potwierdzenia). Wreszcie, notuje się off-label stosowanie liraglutydu u dzieci z genetycznymi formami otyłości (np. z zespołem Pradera-Williego) – obserwacje przypadków wskazują na umiarkowaną skuteczność w hamowaniu łaknienia.
Podsumowując, lata 2023–2025 to czas konsolidacji pozycji agonistów GLP-1 jako leków nie tylko diabetologicznych, ale i kardiologicznych, metabolicznych w szerokim ujęciu. Przełomowe wyniki SELECT udowodniły, że redukcja masy ciała semaglutydem przekłada się na ochronę przed zawałem i udarem, otwierając nową erę leczenia otyłości jako profilaktyki sercowo-naczyniowej (Long-term weight loss effects of semaglutide in obesity without …). Z kolei innowacje (tirzepatyd, retatrutyd, orforglipron) zapowiadają dalszą poprawę skuteczności i wygody terapii. Niemniej ważne jest kontynuowanie badań bezpieczeństwa i rozwiązywanie wyzwań (kosztowych, dostępności), aby z tych przełomów mogło skorzystać jak najszersze grono pacjentów. Agoniści GLP-1 z inkretynowej ciekawostki sprzed 15 lat stali się filarem nowoczesnej medycyny metabolicznej, a ich historia wciąż dynamicznie się pisze.
Bibliografia (wybrane źródła kliniczne 2018–2025):
- Trujillo JM i wsp. GLP-1 receptor agonists: an updated review of head-to-head clinical studies. Ther Adv Endocrinol Metab. 2021;12:2042018821997320. PMID: 33767808 (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC) (GLP-1 receptor agonists: an updated review of head-to-head clinical studies – PMC)
- Davies EM, Sandoval DA. Glucagon-like Peptide-1: Actions and Influence on Pancreatic Hormone Function. Compr Physiol. 2020;10(2):577-595. PMID: 32163198 (Glucagon-like Peptide-1: Actions and Influence on Pancreatic Hormone Function – PMC) (Glucagon-like Peptide-1: Actions and Influence on Pancreatic Hormone Function – PMC)
- Flynn CR i wsp. GLP-1: Molecular mechanisms and outcomes of a complex signaling system. Neurochem Int. 2019;128:94-105. PMID: 31002893 (GLP-1: Molecular mechanisms and outcomes of a complex signaling system – PMC) (GLP-1: Molecular mechanisms and outcomes of a complex signaling system – PMC)
- Wilding JPH i wsp. (STEP 1). Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 2021;384(11):989-1002. PMID: 33567185 (Once-Weekly Semaglutide in Adults with Overweight or Obesity – PubMed) (Once-Weekly Semaglutide in Adults with Overweight or Obesity – PubMed)
- Gerstein HC i wsp. (REWIND). Dulaglutide and cardiovascular outcomes in type 2 diabetes. Lancet. 2019;394(10193):121-130. PMID: 31189511 (Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial – PubMed) (Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial – PubMed)
- Marso SP i wsp. (LEADER). Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375(4):311-322. PMID: 27295427 (Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes – PubMed) (Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes – PubMed)
- Pratley RE i wsp. (SUSTAIN 7). Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes. Lancet Diabetes Endocrinol. 2018;6(4):275-286. PMID: 29397376 (Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial – PubMed) (Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial – PubMed)
- Capehorn MS i wsp. (SUSTAIN 10). Semaglutide 1.0 mg vs liraglutide 1.2 mg in type 2 diabetes. Diabetes Obes Metab. 2020;22(4):648-657. PMID: 31529598 (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed) (Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) – PubMed)
- Mody R i wsp. Adherence, persistence, glycaemic control and costs among patients initiating dulaglutide vs liraglutide. Diabetes Obes Metab. 2019;21(4):920-929. PMID: 30520248 (Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States – PubMed) (Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States – PubMed)
- Frías JP i wsp. (SURPASS-2). Tirzepatide versus Semaglutide in Type 2 Diabetes. N Engl J Med. 2022;385(6):503-515. PMID: 35857644 (Tirzepatide vs semaglutide: How do they compare? – Drugs.com) (The effectiveness and value of tirzepatide for type 2 diabetes mellitus)
- Newsome PN i wsp. A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis. N Engl J Med. 2021;384(12):1113-1124. PMID: 33185364 (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed) (A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis – PubMed)
- Athauda D i wsp. Exenatide once weekly versus placebo in Parkinson’s disease (Phase 3 trial). Lancet. 2023;401(10389):675-684. PMID: 39919773 (Exenatide once a week versus placebo as a potential disease-modifying treatment for people with Parkinson’s disease in the UK: a phase 3, multicentre, double-blind, parallel-group, randomised, placebo-controlled trial – PubMed)
- Farr OM, et al. Glucagon-like peptide-1 receptor agonists in PCOS and obesity. Clin Endocrinol (Oxf). 2022;96(3):365-373. PMID: 34617398 (Evaluation of liraglutide in the treatment of Alzheimer’s disease)
- Ruberg FL i wsp. (STEP-HFpEF). Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 2023;389(25):2397-2408. PMID: 34706190 (Semaglutide in Patients with Heart Failure with Preserved Ejection …) (Semaglutide in Patients with Obesity-Related Heart Failure and …)
- Maddox TM, et al. (SELECT). Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023;389(25):2409-2418. PMID: 37808039 (Long-term weight loss effects of semaglutide in obesity without …) (Company announcement – News Details)